ЦИТОТОКСИЧНОСТЬ
ФОТОГЕМСОДЕРЖАЩЕЙ ФЕРРИЖИДКОСТИ В ПЕРЕМЕННОМ МАГНИТНОМ ПОЛЕ
Н. А.
Брусенцов, Л. X. Комиссарова,
Т. Н. Брусенцова,
Ф. С.
Байбуртский, А. Ф. Миронов, А. В. Любешкин,
Е. Ю. Филинова, Т. Г. Николаева, Л. И. Шумаков, А. Ю. Барышников
Российский онкологический научный центр им. Н. Н. Блохина
РАМН, Москва;
Институт биохимической физики им. Н. М. Эмануэля РАН,
Москва;
Российский химико-технологический университет им. Д. И.
Менделеева, Москва;
Московская Государственная академия тонкой химической
технологии им. М. В. Ломоносова, Москва;
Всероссийский НИИ радиотехники, Москва.
Понижение
выживаемости клеток, содержащих вещества, возбуждаемые светом, зависит от
степени их фотосенсибилизации [1 - 13]. Понижение выживаемости клеток,
содержащих вещества, возбуждаемые переменным магнитным полем (ПМП) в темноте,
зависит от степени их темновой магнитосенсибилизации [5], тогда как понижение
выживаемости клеток, содержащих вещества, нагреваемые индукционно и возбуждаемые
ПМП или конвенционным нагревом в темноте, зависит от степени их темновой
магнито-термосенси-билизации [6].
Мы разработали
магнитоуправляемые наночастицы декстранферрита (ДФ) [14] для индукционной гипертермии
(ИГ) опухолевых клеток в ПМП [15] и темновой термосенсибилизации (ТС) [6].
Золи ДФ,
полученные растворением ДФ в воде, могут служить идеальными магнитными
носителями [14-16]. При инкубировании клеток асцитической саркомы МХИ в золях
ДФ при +37 °С в концентрации до 80 мг/мл не наблюдалось острой и хронической
токсичности или гибели клеток [15]. Острая токсичность при внутривенном и
внутриперитонеальном введении ДФ: ЛД50 5,0 г/кг для мышей; 0,6 - 1,5
г/кг для кроликов, 0,5 - 0,9 г/кг для собак [16]. Ферримаг-нитные жидкости
(ФЖ), полученные из ДФ, служат магнитными носителями [14-16], кроме того, ДФ
рассеивает энергию переменного магнитного поля и, таким образом, вызывает
гипертермию в зоне своей локализации [15 - 24].
Гематопорфирин
(ГП), его производные, например, фотогем (ФГ) [1-4] и другие агенты, у которых
при облучении светом с длиной волны 600 - 1000 нм возбуждаются электроны,
генерируются супероксид-ани-онрадикалы и синглетныи кислород, повышающие
ци-тотоксичность, относятся к классу фотосенсибилизаторов. Мы разработали
аналог гематопорфирина, фотогем [1-4], и использовали его при темновой
ФГ-магнито-ДФ-термосенсибилизации опухолевых клеток в ПМП [22 - 24].
ФГ по аналогии с
ГП [6] генерирует суперок-сид-анионрадикал, образующий синглетныи кислород [5,
8], который приводит опухолевые клетки к разрушению. Кроме того в процессе
ФГ-магнитотермосен-сибилизации (ФГ-МТС), так же как при фотосенсибилизации,
возможно повышение способности интеркалированных в мембране клеток частиц ФГ
генерировать свободные радикалы.
Гистидин (Гис)
является известным акцентом синглетного кислорода [5]. Увеличение повреждающего
действия ГП при гипертермии клеток тормозилось прибавлением Р-каротина,
известного перехватчика синглетного кислорода или супероксид-анионрадика-ла, но
не тормозилось прибавлением маннитола, который является перехватчиком только
гидроксильных радикалов [8].
Гематопорфирин и
его производные повышают радиосенсибилизирующий эффект 2-дезокси-В-глюкозы на
опухолевые клетки, вероятно, посредством дальнейшего понижения запаса энергии,
приводящего к обратимому ингибированию репарации ДНК, увеличению
цитогенетических повреждений и смерти клеток [8-10].
Анализ
публикаций по ФГ (Россия) и фотофрину (ФФ, США) показали, что эти соединения
очень близки по структуре, физико-химическим свойствам и терапевтическим
характеристикам [7-12]. Тринадцать больных саркомой (стадия FIGO 1а) с первичными или остаточными (после
конвенционной терапии) опухолями различной локализации лечили с применением
методов фото динамической терапии (ФДТ). Через 24 - 72 ч после внутривенного
введения производных ГП (Photosan III, 2 мг/кг) опухоли облучали аргоновым лазером. Облучение
внутриполостных опухолей проводили с помощью оптоволоконных устройств под
контролем ультразвука.
Поверхностные
опухоли и небольшие поражения, расположенные близко к поверхности кожи,
облучали падающим светом; при опухолях, расположенных на глубине, превышающей 1
см, применяли внутритканевое облучение. Результаты лечения оценивали через 1
месяц после терапии. Полная ремиссия была достигнута у 8 больных, частичная
ремиссия — у 2, не наблюдалось ремиссии у 3 больных с кровоточащим раком
эндометрия. Последующую радиотерапию использовали при долечивании этих больных
[11]. При лечении ФФ полная и частичная регрессия опухолей регистрировалась у
98 % больных [7], при лечении ФГ — у 94 % [12]. В клинической онкологии ФГ
применяют при ФДТ злокачественных опухолей в дозах от 1,5 до 3 мг/кг[12, 13].
Нерешенной
технической проблемой фотодинамической терапии является фотовозбуждение
вещества в опухоли светом с длиной волны между 600 и 1000 нм, в тканях тела
лишь на глубине до 3 мм [7]. При индукционной гипертермии опухолей полная
гибель опухолевых клеток достигалась лишь при относительно высоких дозах ДФ
[15].
Целью работы
явилась оценка цитотоксичности магнитных жидкостей; золей фотогема; магнитных
жидкостей, содержащих фотогем при магнито-сенси-билизации (МС) опухолевых
клеток фотогемом в темноте (ФГ-МС); при термосенсибилизации (ТС) опухолевых
клеток фотогемом в темноте (ФГ-ТС); при комбинации ФГ-МС и ФГ-ТС опухолевых
клеток в темноте — магнитотермосенсибилизации (ФГ-МТС), чтобы оценить влияние
переменного магнитного поля и индукционной гипертермии при температуре от +37
до +44 °С на гибель и лизис опухолевых клеток в магнитных жидкостях в
присутствии фотогема.
В связи с этим,
задачей исследования является изучение влияния на выживаемость опухолевых
клеток гипертермии; ДФ; ФГ; ДФ + ФГ; Гис; ФГ + Гис; ПМП; ФГ в ПМП; ФГ при
гипертермии в ПМП; ДФ + ФГ в ПМП, ФГ + Гис в ПМП в темноте с целью определения
оптимальных условий и механизма повреждения опухолевых клеток. Полученный нами
декстранфер-рит [14] и импортный декстран магнетит (ДМ) [17, 18] довольно
близки по структуре, физическим и химическим свойствам, по применению в
диагностике и терапии опухолей [19]. Это объясняется тем, что оба соединения
состоят из твердых наночастиц диаметром 60 - 240 нм, синтезированных одним
методом из тех же исходных материалов: декстрана и магнетита.
Материалы и методы
Образец исходной
феррижидкости лиофилизовали и полученный порошок суспендировали в очищенной
воде. По модифицированной методике [16] приготовили и испытали 5
декстранферритовых водных ферри-жидкостей с содержанием ДФ, %: 12,0; 0,6; 0,2;
0,02 и 0,002.
Для
феррижидкостей определили рН среды, электрокинетический потенциал частиц,
намагниченность насыщения Ms удельную
абсорбцию энергии (ОДЗ) и другие физико-химические характеристики, а также биологические
свойства по методам [15, 16]. Аналитическое фракционирование ферримагнитных
частиц осуществили постепенным пропусканием 1 % золей ДФ через набор фильтров с
использованием устройств фирмы Амикон. Анализ распределения частиц по величине
их диаметров провели с использованием систем Submicron Particle Sizer NICOMPTM 380 PSS NI-COMP "Particle Sizing Systems, Inc." Santa Barbara, Calif., USA.
Таблица 1
Влияние
конвенционной гипертермии на выживаемость клеток Р388 при температуре от +37
до +44 °С, экспозиция 30 мин
|
Пробирка |
Выжившие |
Мертвые |
Лизированные |
Температура. |
|
|
|
клетки,% |
клетки, % |
клетки,% |
°C |
|
|
1 |
0,0 |
97 ±6 |
3±0,6 |
43-44 |
|
|
2 |
4 ±0,8 |
96 ±5,8 |
2 ±0,6 |
42-43 |
|
|
3 |
48 ±3,4 |
52 ±3,6 |
2 ±0,5 |
41 -42 |
|
|
4 |
91 ±5,5 |
9 ±1,4 |
1 ±0,4 |
39-40 |
|
|
5 |
95 ±5,8 |
5 ±1,0 |
1 ±0,3 |
37-38 |
|
|
6 |
96 ±5,8 |
4 ±0,8 |
0,0 |
37 |
|
ФГ получали
обработкой гемина 50 % раствором бромистого водорода в уксусной кислоте с
последующим прибавлением уксусной кислоты, ацетата натрия и воды. Выпавший из
раствора диацетат производного гемина обрабатывали 0,1 н. раствором NaOH в течение 1 ч. ФГ осаждали уксусной
кислотой, фильтровали, промывали и сушили на воздухе. Получался темно-фиолетовый
кристаллический порошок, представляющий собой сложную смесь мономерных и
олигомерных полусинтетических порфиринов. Растворение полученного порошка в
0,5 % гидроксиде натрия с последующим его доведением до рН 7,4 1 н. хлористоводородной
кислотой привело к образованию золя ФГ. Готовили и тестировали 8 водных золей
фотогема, которые получили по модифицированной методике [2]. Концентрация
фотогема в полученных золях (мкг/мл) — 650; 65; 6,5; 3,2; 1,6; 1,3; 0,12; 0,02.
Физико-химические характеристики и биологические свойства золей ФГ определяли
как представлено в [1 -4, 7]. Аналитическое фракционирование твердых частиц ФГ
осуществляли постепенным пропусканием 1 % водных золей ФГ через мембранные
фильтры (100 нм, 45 нм, 20 нм, ХМ300, ХМ 100, ХМ50, UM20-UM05u) под давлением азота 0,1-0,Зати на устройствах Amicon TSF-10 thin-channel ultrafiltration system or in Model 12 and Model 202 cells, и на колонке для гель фильтрации. Олигомерную структуру
ФГ определили при гель-фильтрации, на сорбенте Fracto-gel HW-40S (Merk, Germany), в системе
ДМСО - толуол-уксусная кислота (1/1/1). При определении распределения твердых
частиц по величинам их диаметров в золях ФГ использовали Gaussian/Nicomp and Volume-weighted Gaussian анализ распределения частиц в
разбавленных золях ФГ, при котором использовали (Submicron Particle Sizer NICOMPTM 380 PSS NI-COMP "Particle Sizing Systems, Inc." Santa Barbara, Calif., USA).
Полученный нами
ФТ по своим физико-химическим характеристикам и терапевтическим свойствам
очень близок ГП и ФФ [4, 7] и относится к производным гематопорфиринов,
структурные формулы которых представлены [6].
Два типа
опухолевых клеток: адаптированной карциномы яичников человека (carcinoma ovarii, CaOv) и мышиного асцитического лимфолейкоза
Р388, — инкубировали при воздействии физических факторов в присутствии или без
упомянутых выше реагентов и факторов. Переменное магнитное поле достигалось
внутри индукционной катушки, охлаждаемой водой (диаметр катушки 9 см, 20 витков
с расстоянием меж-
ду витками 0,9
см). Клетки последовательно нагревали от +37 до 44 °С и подвергали воздействию
ПМП в индукционной катушке при частоте 0,88 МГц, индукции 9,3 кА/м и мощности
0,15 кВт. Определяли выживаемость клеток CaOv и Р388 как результат их экспозиции при различных
температурах в нормальных условиях и в ПМП при различных концентрациях ФГ в
присутствии гистидина (ФГ + Гис). В предварительных опытах in vitro определяли параметры температуры и ПМП, необходимые для
сенсибилизации опухолевых клеток, содержащих ФГ. Изучали
магнито-тер-мосенсибилизацию клеток частицами ФГ в темноте, достигаемую
одновременно действием ПМП и гипертермией в проточном термостате. При
ФГ-термосен-сибилизации пробирки с суспензией опухолевых клеток (концентрация
106 мл) совместно с реагентами (ФГ, Гис, ФГ + Гис, 0,9 % раствор NaCl) помещали в проточный термостат; при
ФГ-магнитосенсибилиза-ции такие же пробирки помещали в центр индукционной
катушки; при ФГ-МТС термостатированные пробирки помещали в центр индукционной катушки
и выдерживали 30 мин в ПМП в темноте при периодическом выключении генератора
ПМП для поддержания постоянной температуры. Поэтому повышение температуры
клеток не было пропорционально повышению концентрации ДФ.
Для подсчета
исходного числа клеток до их обработки, а также выживших, мертвых и
лизированных клеток после обработки, их бкрашивали трипановым синим. Разность
между исходным и конечным числом клеток отнесли за счет лизиса.
Раствор
трипанового синего 0,4 % 0,5 мл, 0,3 мл раствора Хенкса и 0,2 мл суспензии
клеток в пробирке перемешивали и выдерживали 6 мин. Кончиком пипетки вводили
небольшие количества суспензии в обе камеры гемоцитометра. Подсчитывали все
клетки в 1 мм центральном квадрате и угловых квадратах 1 камеры. Мертвые
клетки окрашивались в синий цвет. Отдельно подсчитывали выжившие и мертвые
клетки.
Флуоресцентную
микроскопию клеток проводили после их обработки 3-15 мин растворами, содержащими
летальные дозы ФГ, с последующим отмыванием 0,9 % раствором NaCl.
Выживаемость
клеток CaOv или Р388
оценивали подсчетом выживших клеток на гемоцитометре после экспозиции клеток в
различных условиях с NaCl, ДФ, ФГ, ФГ + ДФ,
ФГ + Гис. Взаимодействие ДФ с клетками изучали с учетом рекомендаций [16].
Результаты конвенционной гипертермии, ПМП, комбинированного действия
индукционной гипертермии и магни-то-термосенсибилизации обрабатывали статистически.
Результаты представлены как средние значения (+-SD), полученные в 4 независимых опытах.
Таблица 2
Влияние
декстранферрита (ДФ) на выживаемость клеток CaOv при экспозиции в ПМП 30 мин при индукционном нагреве от +37
до +44 °С.
|
Пробирка |
Выжившие клетки,% |
Мертвые клетки, % |
ДФ, мг/мл |
Температура. °C |
|
1 |
0,0 |
100 ±6 |
60,0 |
43-44 |
|
2 |
4 ±0,8 |
96 ±5,8 |
6,0 |
42-43 |
|
3 |
48 ±3,4 |
52 ±3,6 |
1,00 |
41-42 |
|
4 |
91 ±5,5 |
9 ±1,4 |
0,10 |
39-40 |
|
5 |
95 ±5,8 |
5 ±1,0 |
0,01 |
37-38 |
|
6 |
96 ±5,8 |
4 ±0,8 |
0,00 |
37 |
Результаты и их обсуждение
В процессе
получения ДФ и ДМ было проведено сравнение химического состава полученных
препаратов. Сравнение показало, что ДФ по составу близок ДМ: ДФ представляет собой
темно-коричневые листочки и содержит около 27 % y-Fe2O3, 71 % декстрана и 2 % воды; величина удельной намагниченности насыщения
образца а составила 18 А • м2/кг. Инфракрасный (ИК) спектр,
измеренный в таблетках КВг, имел абсорбцию при утах(см-1)
= 3400, 2900, 1630, 1350-1420, 1000-1150 и 550-600. Летальная доза на мышах при
внутривенном введении (ЛД50) — 5 г/кг.
Феррижидкость,
содержащая 12 % ДФ, представляла собой темно-коричневый золь; рН среды 7,
величина электрокинетического потенциала частиц +15 мВ, намагниченность
насыщения Ms 0,7 кА/м. ДФ
рассеивает энергию переменного магнитного поля и таким образом вызывает
гипертермию в месте своего нахождения. Удельная абсорбция энергии (УАЭ) ДФ 240
- 360 Вт/г Fe.
При
обезвоживании золя ДФ прибавлением этанола, метанола, ацетона или октана, а
также путем лио-филизации с последующим растиранием остатка в фарфоровой ступке
получили коричневый гигроскопичный порошок. Полученный порошок растворим в
воде с образованием коллоидных растворов с концентрацией частиц магнитной фазы
0,001 - 60,0 масс. %. Повторная лиофилизация ДФ феррижидкостей и растворение
ДФ в воде не приводит к значительным изменениям его свойств. Эти результаты
согласуются с гипотетической моделью строения микросфероидов ДФ. Согласно этой
модели микросфероид ДФ состоит из центрального ядра (сферического кристаллита
у-ок-сида железа), покрытого слоем химически связанных с ядром и скрученных
молекул декстрана. Твердой фазой феррижидкостей на основе ДФ и воды являются
мицеллы, кристаллические ядра которых покрыты набухшим слоем гидратированных
молекул декстрана. Микросфероиды ДФ находятся в золе в виде мицелл. Структура
аморфного декстранового слоя мицелл ДФ представлена тонкими волнистыми
"ворсинками" различной длины. Последние представляют собой цепные
молекулы декстрана, химически присоединенные различными участками к
кристаллическому ядру, свободные концы молекул декстрана совершают колебания
под воздействием броуновского движения молекул среды в золе.
Данные
просвечивающей электронной микроскопии позволили оценить размеры частиц ДФ:
максимальный диаметр микрокристаллов и микросфероидов равен 12 и 240 нм,
соответственно. Полученные результаты согласуются с данными аналитического
фракционирования частиц, их динамического светорассеяния (193 -240 нм) и
Гаусовского анализа распределения частиц по размерам в разбавленных растворах
(рисунок). Изучаемые водные золи ДФ являются фер-римагнитными жидкостями,
дисперсная фаза которых представляет собой мицеллы. В разбавленных золях, вне
сильных электрических и магнитных полей, мицеллы имеют сферическую форму и
проявляют взаимное отталкивание. В неоднородном постоянном магнитном поле
индукцией 0,01 - 3 Тл мицеллы ДФ в золях, в результате их взаимного
притяжения, проявляют магнитную упорядоченность. Водные золи ДФ, имеющие
концентрации от 1 до 55 вес. %, не проявляют необратимого расслоения при
хранении в течение 1 года при +4 °С и выдерживают экспозицию до 1 ч в
неоднородном постоянном магнитном поле индукцией до 0,2 Тл.
Опухолевые клетки
многих типов при 72 ч экспозиции в 1 % золях ДФ способны абсорбировать мицеллы
ДФ и метаболизировать декстрановый слой, покрывающий кристаллическое ядро. В
результате переваривания органической компоненты мицелл ДФ в клетках
"облысевшие" ферритовые ядра (10 - 12 нм в диаметре), потерявшие
коллоидную защиту, образуют внутри клеток конгломераты диаметром 0,1-1,0 мкм,
состоящие из смеси y-Fe2O3 и Fe3O4 [20,21]. Конгломераты y-Fe2O3 и Fe3O4 легко определяются с помощью микроскопа при увеличении 40
х 10. При образовании ферритовых конгломератов в клетках не происходит
заметного понижения удельной намагниченности насыщения частиц, но резко
понижается УАЭ из-за увеличения диаметров частиц оксидов железа до размеров,
превышающих размеры однодоменной структуры. Опухолевые клетки, содержащие 3 -
12 видимых в микроскоп конгломератов продолжают некоторое время развиваться и
делиться. Учитывая это и низкую токсичность ДФ при внутрисосудистом введении животным,
феррижидкости на основе ДФ могут стать идеальными магнитными носителями [15].
Чтобы определить
оптимальные условия, при которых проявляется максимальный пироэлектрический эффект
ДФ в ПМП, измерили частотную зависимость потерь при гистерезисе 30 % золя ДФ.
Было найдено, что величина добротности (Q) ДФ в ПМП монотонно понижается с увеличением частоты выше 0,19
МГц. Принимая во внимание полученные результаты, выбрали частоту 0,88 МГц.
Определения показали прямую зависимость понижения намагниченности золя и
скорости индукционного нагрева от уменьшения концентрации ДФ. В
предварительных опытах in vitro определили
оптимальные параметры температуры и ПМП, необходимые для возбуждения ФГ в
пробирках с опухолевыми клетками. На частоте 0,88 МГц нагрев 0,9 % раствора NaCl всегда был ниже уровня чувствительности
спиртового термометра. Исследуемая 12 % феррижидкость ДФ на этой частоте
проявила удовлетворительную скорость нагрева до +2 °С/мин.
Таблица 3
Влияние фотогема
(ФГ) на выживаемость клеток CaOv при экспозиции 30
мин в ПМП при +37 °С.
|
Пробирка |
Выжившие клетки, % |
Мертвые клетки, % |
Лизированньк клетки, % |
ФГ, мкг/мл |
|
1 |
0,0 |
0,0 |
100 ±6 |
325,00 |
|
2 |
9,5 ±1,5 |
60 ± 4,0 |
30,5 ±2,5 |
32,50 |
|
3 |
18 ±1,9 |
54 ±3,7 |
28 ±2,5 |
3,25 |
|
4 |
87,3 ±5,5 |
5,7 ±1,0 |
7,0 ±1,3 |
0,65 |
|
5 |
91 ±5,5 |
5 ±1,0 |
4 ±0,8 |
0,06 |
|
6 |
95 ±5,8 |
4 ±0,8 |
1 ±0,1 |
0,00 |
Результаты Gaussian/Nicomp-анализа распределения частиц по величине их диаметров в 0,001 %
золе ДФ представлены на рисунке.
Результаты,
полученные при изучении цитотоксич-ности золей, представлены в табл. 1 - 4. Не
отмечено гибели значительного числа клеток от хронической или острой
токсичности, когда клетки инкубировали только в феррижидкостях с концентрацией
ДФ до 60 мг/мл или только в ПМП до 6 ч при 37 °С. Однако, когда клетки Р388 или
CaOv выдерживали в
ПМП при температурах от +41 до +44 °С 30 мин в присутствии феррижидкости,
наблюдался выраженный гипертермический эффект (табл. 2).
Обобщенный
результат распределения частиц по величине их диаметров в золе ФГ представлен в
работе [6]. Гель-хроматограмму фотогема [6] получили на колонке для
гельфильтрации: 400 х 13 мм; насос, JAS-СО PU-980; скорость элюции 0,25 мл/мин; скорость бумаги 0,03
мм/мин.
В результате
проведенных исследований по механизмам разрушения опухолевых клеток была
определена роль: ДФ, ФГ, Гис, ФГ + ДФ, ФГ + Гис; конвенционной гипертермии,
ПМП, индукционной гипертермии в ПМП; темновой ФГ-магнито-термосенсибили-зации
клеток.
ФГ по аналогии с
ГП возбуждается в ПМП в темноте в результате повышения энергии электронов,
генерирует синглетный кислород и супероксид-анион радикалы. Синглетный
кислород, являясь сильным окислителем, вызывает разрушение опухолевых клеток.
Экспериментальные
результаты определения цито-токсичности конвенционной и индукционной гипертермии
представлены в табл. 1, 2; цитотоксичность, проявляемая фотогемом, в различных
условиях представлена в таблицах 3,4.
Не отмечена
гибель клеток при хронической или острой токсичности, когда клетки инкубировали
при +37 °С в золях ФГ с концентрацией до 0,01 мкг/мл или только в ПМП до 6 ч
при +37 °С. Отмечено уменьшение фракции выживших клеток при повышении
температуры от 41 до 44 °С (табл. 1). Фракция мертвых клеток увеличивалась
пропорционально повышению температуры от 41 до 44 °С; фракция выживших клеток
была высокой при температуре от 37 до 41 °С, при 42 - 43 °С — незначительной, и
при 43 - 44 °С — отсутствовала. Температура в пробирках 1-6 повышалась
пропорционально увеличению концентрации ДФ; фракция мертвых клеток
увеличивалась пропорционально увеличению концентрации ДФ; фракция выживших
клеток была высокой при температуре от 37 до 41 °С, при 42 - 43 °С —
незначительной, и при 43 - 44 °С — отсутствовала (табл. 2). Согласно полученным
результатам при равных концентрациях ФГ выживаемость клеток в 3 раза меньше при
комбинированном действии ФГ+ПМП по сравнению с действием только ФГ.
Так, при
концентрации 32,5 мкг/мл выживаемость клеток 9,5 и 29 % соответственно
(пробирка 2 в табл. 3 и 4).
Цитотоксичность
ФГ при +41 °С в 3 раза ниже, чем цитотоксичность ФГ в комбинации с ПМП при тех
же температуре и концентрации. Так, выживаемость клеток при +41 °С и
концентрации ФГ 32,5 мкг/мл соответствовала 10 % по сравнению с 29 % (пробирка
2, табл. 4) при температуре +37 °С. Таким образом, полученные результаты
подтверждают преимущества ФГ-термосенсибилизации, ФГ-магнитосенсибилиза-циц и
ФГ-магнито-ДФ-термосенсибилизации клеток. Сравнение данных подтверждает
равноценность цито-токсических эффектов комбинированного действия на клетки CaOv и Р388. ФГ-термосенсибилизация приводит
к понижению выживаемости клеток, содержащих фотогем, при темновой гипертермии.
ФГ-магнитосен-сибилизация приводит к понижению выживаемости клеток, содержащих
фотогем, в ПМП в темноте. ФГ-магнито-термосенсибилизация приводит к понижению
выживаемости клеток, содержащих фотогем, в ПМП при темновой гипертермии.
Действие ФГ в нетоксичных дозах зависит от величины применяемой дозы при +37
°С, его повреждающее действие на опухолевые клетки значительно повышается в
ПМП при +41 °С и выше. Эти данные подтверждают возможность использования
конвенционной гипертермии и ПМП в комбинации, представляющей собой
ФГ-маг-нито-термосенсибилизацию опухолевых клеток. Повышение повреждающего
действия клеток фотогемом в ПМП в результате ФГ-магнито-термосенсибилизации
эффективно подавляется прибавлением гистидина, который является перехватчиком
супероксид-анион радикала и синглетного кислорода. В присутствии нетоксичных
доз ФГ + Гис фракция выживших клеток уменьшается пропорционально понижению
температуры. Определены значительные различия между ци-тотоксическими
эффектами, вызванными фотогемом в ПМП при +37 °С и +41 °С при тех же
концентрациях фотогема. Таким образом, при нетоксичных дозах ФГ для повреждения
опухолевых клеток требуется ФГ-магнито-сенсибилизация и ФГ-термосенсибилизация
или их комбинация, ФГ-магнито-термосенсибилизация.
Таблица 4
Влияние ФГ на
выживаемость клеток CaOv при экспозиции 30
мин в проточном термостате при +37 °С (Пробирки 1 - 3) и при +41 °С (Пробирки 4
- 6).
|
Пробирка |
Выжившие клетки, % |
Мертвые клетки, % |
Лизированные клетки, % |
ФГ мкг/мл |
|
1 |
3±0,6 |
6±1,1 |
91 ±5,5 |
325 |
|
2 |
29 ± 2,5 |
50 ±3,5 |
21 ±2,0 |
32,5 |
|
3 |
66 ± 4,3 |
16 ±1,8 |
18 ± 1,9 |
3,25 |
|
4 |
10 ±1,5 |
55 ±3,8 |
35 ±2,8 |
32,5 |
|
5 |
38 ±2,9 |
39 ±3,0 |
23 ± 2,2 |
3,25 |
|
6 |
82 ±5,1 |
14 ±1,7 |
4 ±0,8 |
0,32 |
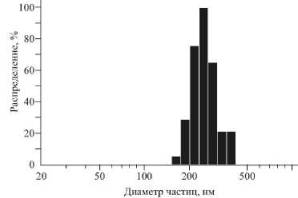
Распределение твердых частиц по величине диаметров в 0,001 %
феррижидкости декстранферрита.
Определены значимые различия между цито-токсическими
эффектами, вызванными индукционной гипертермией, магнито-термосенсибилизацией и
комбинацией индукционной гипертермии с магнито-термосенсибилизацией.
Флуоресцентная
микроскопия клеток, обработанных ФГ, с последующим отмыванием физиологическим
раствором, показала, что в основном ФГ был локализован в мембранных структурах
клеток. Учитывая перечисленное возможны следующие механизмы проявления
цитотоксического действия ФГ на клетку: твердые частицы ФГ, аналогично другим
липофиль-ным производным ГП, интеркалируют между липид-ными молекулами
мембраны, индуцируют мембра-но-зависимые повреждения, приводящие к морфологической
денатурации клеточных мембран, к изменению соотношения
"насыщенные/ненасыщенные жирные кислоты" в составе мембранных
липидов, и к образованию химических связей, сшивающих компоненты клеточных
мембран и разрывы цепей ДНК. Гибель и лизис опухолевых клеток объясняются в
этих случаях достижением концентрации ФГ, обеспечивающей скорость нанесения
повреждений, превышающую скорости внутриклеточных репараций.
Механизмы
сенсибилизации клеток с их последующими гибелью и лизисом можно объяснить
поглощением энергии ПМП частицами фотогема, переходом их в возбужденное
синглетное состояние, а также процессами релаксации энергии возбуждения.
Релаксация может осуществляться путем интерконверсии в первое триплетное состояние
при дальнейшем взаимодействии с субстратом или 02 или возвращением в основное
состояние с испусканием энергии. Все факторы, снижающие устойчивость клеток и
тормозящие их репарационные процессы (гипертермия, снижение рН, радиация,
химиотерапия) повышают разрушительный эффект ФГ.
Положительные
результаты лечения опухолей экспериментальных животных в предварительных опытах
подтверждают возможность создания на основе ФГ-МТС опухолевых клеток нового
способа терапии, который по аналогии с фотодинамической терапией (ФДТ) можно
назвать магнито-термодинамической терапией (МТТ).
ФГ-МТТ по
сравнению с ФДТ представляет следующие преимущества: возбуждение частиц
фотогема ПМП на любой глубине тканей тела; ФГ-дозо-зависи-мое повышение
повреждающего действия гипертермии и ПМП на опухолевые клетки; отсутствие
специфической токсичности при физиологических параметрах гипертермии и ПМП
(температура, частота, индукция, сила и мощность).
Действие ФГ
зависит от величины применяемой дозы при +37 °С, его повреждающее действие на
опухолевые клетки значительно повышается при +41 °С и выше. Дальнейшие
исследования in vitro та in vivo позволят
подобрать оптимальные дозы ФГ + ДФ и параметры интенсивности и
продолжительности действия ПМП на опухоли. Комбинация конвенционной гипертермии
с магнито-термосенсибилизацией при лечении опухолей фотогемом является фундаментом
метода магнито-термодинамической терапии опухолей.
Перемешивание
фотогема с растворами гидроксида натрия с последующей нейтрализацией
хлористоводородной кислотой приводит к образованию золей ФГ пригодных для
ФГ-магнито-термосенсибилизации опухолей. Смешивание золей фотогема с золями
дек-странферрита в воде приводит к образованию фото-гем-содержащих
феррижидкостей, пригодных для
фо-тогем-магнито-декстранферрит-термосенсибилизации опухолевых клеток. Механизм
ферримагнитного нагрева, наиболее вероятно, включает процесс потерь при
магнитной релаксации. Фотогем-магнито-декст-ранферрит-термосенсибилизация
опухолевых клеток, наиболее вероятно, включает свободнорадикальные процессы.
ЛИТЕРАТУРА
1. А.Ф.Миронов, А.
Ю. Нокель, и др. Патент России №2063671 ot05.11.1993, Б. И. №
2. A. F. Mironov, A. N. Nizhnik and A. Yu. Nockel, J. Photochem.
Photobiol., 4, 297 - 306, (1990).
3. A. F. Mironov, Proc. of the Int. Conf. on
Photodynamic Therapy, Sofia (1989), p. 13.
4. A. F. Mironov, A. N. Nizhnik and A. Yu. Nockel, J. Photochem.
Photobiol. B: Biology, 6, 337 - 341 (1990).
5. M. Babincova, D. Leszczynska, P. Sourivong, and P.
Babinec., J. Magn. Magn. Mater., 225, 194-196 (2001).
6. H. А. Брусенцов, Л. X. Комиссарова, Т.
Н. Брусенцова., Хим.-фарм. журн., 37(6), 10 - 15 (2003).
7. H. Kato, N. Kawate, K. Kinohita, et al., Ciba Found
Symp, 146, Photosensitizing compounds: their chemistry, biol. and clinical
use, (1989), pp. 183-197.
8. B. S. Dwarakanath, J. S. Adhicari, and V. Jain., Radiation
Oncol. Biol. Phys., 43(5), 1125 - 1133 (1999).
9. Z. Lacos, and T. Berki., J. Photochem.
Photobiol. B: Biology, 29, 185-191,(1995).
10. G. Moger, and G. Kohler, N. Getoff., J.
Photochem. Photobiol. B: Biology, 33, 27 - 37 (1996).
11. H. Koran and G. Alth, J. Photochem. Photobiol.
B: Biology, 36, 189-191 (1996).
12. В. И. Чиссов,
О. К. Скобелкин, А. Ф. Миронов и др., Хирургия, № 12, 3 - 6 (1994).
13. V. V. Sokolov, V. I. Chissov, R. I. Yakubovskya,
et al., Progress in biomedical optics Europto series, Proceeding of
Photoche-motherapy: Photodynamic Therapy and Other Modalities II. Chairs / S.
B. Brown, et al. (ed.), 7-8 September 1996, Viena, Austria, 2924 (1996), pp. 322
- 329.
14. A. I. Autenshlyus, N. A. Brusentsov and A.
Lockshin, J. Magn. Magn. Mater., 122, 360 - 363 (1993).
15. N. A. Brusentsov, V. V. Gogosov, T. N. Brusentsova,
et al, J. Magn. Magn. Mater., 225, 113-117 (2001).
16. O. A. Kuznetsoy, N. A. Brusentsov, N. Y.
Jurchenko, et al., J. Magn. Magn. Mater., 194, 83 - 89 (1999).
17. U. O. Hafeli and G. J. Pauer, J. Magn. Magn.
Mater., 194, 76-82(1999).
18. D. C. F. Chan, D. B. Kirpotin and P. A. Bunn, J.
Magn. Magn. Mater., 124, 374 - 378 (1993).
19. A. Jordan, R. Scholz, K. Maier-Hauff, et al., J. Magn.
Magn. Mater., 225, 118-126, (2001).
20. N. A. Brusentsov, T. S. Gendler, E. A. Haliulina,
et al., Book of abstracts of 9-th IPCMF-2000, Plyos Russi (2000), pp. 77
- 79.
21. N. A. Brusentsov, T. S. Gendler, T. N. Brusentsova,
Magnetisation offerrifluids and effects ofintracellular deposition
offerri-te nanoparticles. Abstracts ICM 2003, July 27-August 1, Roma, Italy
(2003), p. 756.
22. N. A. Brusentsov, L. Kh. Komissarova, A. A.
Kuznetsov, Fourth Int. Conf. on the Scientific and Clinical Applications of
Mgnetic Carriers, Tallahassee, Florida, USA (2002), pp. 81 -84.
23. N. A. Brusentsov, L. Kh. Komissarova, A. A.
Kuznetsov, European Cells and Materials, 3(2), 70 - 73 (2002).
24. N. A. Brusentsov, A. V. Reshetnickov, E. Yu.
Filinova, International Workshop on Recent Advances in Nanotechnology of
magnetic fluids (RANMF-2003), New Delhi, India (2003), pp. 182-185.