ПРИМЕНЕНИЕ МАГНИТНЫХ
НАНОЧАСТИЦ
В ДИАГНОСТИКЕ
И ЛЕЧЕНИИ ТУБЕРКУЛЁЗА
Владимирский М. А. 1, Шипина , Л.К. 1,
Филиппов В. И. 2, Иртуганова О. А. 3, Стаханов В.
А. 4
1.
НИИ
фтизиопульмонологии ММА им. И.М. Сеченова.
2.
Институт
биохимической физики им. Н.М. Эмануэля РАН.
3.
Московский
НПЦ борьбы с туберкулезом.
4.
Московский
государственный медицинский университет.
1. Иммуномагнитная
технология пробоподготовки диагностических образцов для выявления микобактерий туберкулёза методами
люминесцентной микроскопии и полимеразной цепной реакции
Современная диагностика и
дифференциальная диагностика туберкулеза в существенной степени зависит от
эффективности обнаружения микобактерий туберкулеза (МБТ) в диагностических
материалах: в мокроте, как наиболее массовом объекте исследования, моче и
других биологических жидкостях, а также биопсийных материалах.
Основные традиционные
микробиологические методы исследования: микроскопия мазков и культуральное
исследование осадков гомогенизированных и центрифугированных образцов мокроты,
к сожалению, в отечественных специализированных микробиологических
лабораториях весьма малоэффективны. Если в США и Западной Европе МБТ выявляют в
около 80% случаев активного туберкулеза легких, то в России в последние годы, в
связи с использованием традиционно устаревших технологий и проблемами финансирования,
лишь в около 40 %; в СССР – в немного более 50% случаев. Проблемы эффективности
исследований связаны с требованием достаточной чувствительности анализа и
временем, необходимым для получения результатов анализа. Если микроскопия
мазков позволяет выявить 20-30% больных туберкулезом и получить результат
обычно на следующий день, то культуральное исследование (посев) микобактерий
на классических селективных твердых питательных средах занимает обычно 6-12
недель.
Современные более быстрые системы
культивирования типа Bactec,
в которых используются жидкие питательные среды с радиометрической или
флуоресцентной детекцией результатов позволяют определить рост МБТ в течение, в
среднем, 2-х недель, однако, отрицательный результат может быть получен лишь
через 38-42 дня, поскольку к этому времени выявляется рост около 10 % культур
МБТ. К тому же после регистрации положительного результата роста требуется еще
7-10 дней для идентификации принадлежности культивированного материала к
микобактериям туберкулезного комплекса.
Определение МБТ при внелегочных формах
туберкулеза (туберкулез мочеполовой системы, лимфоузлов, костей и суставов)
является еще более трудной проблемой в связи с очень низкой (5-20%)
эффективностью исследований. При этом именно внелегочные формы туберкулеза
наиболее трудны для диагностики при использовании рентгенологических методов
исследования, поскольку они чаще всего не указывают на специфический характер
изменений. И даже морфологическое исследование пункционных биопсийных
материалов не всегда может установить этиологическую природу заболевания.
Молекулярно-генетический анализ, в частности, полимеразная
цепная реакция (ПЦР) стала наиболее крупным достижением в лабораторных технологиях
последнего десятилетия, в том числе в диагностике туберкулеза. Число
публикаций, посвященных применению ПЦР в диагностике туберкулеза приближается
к тысяче. Обзоры этого направления приведены, например, в следующих
публикациях 2001г.: Kaul
K.M. «Molecular detection of M.Tuberculosis: impact of patient care» Clin. Chemistry
2001,47(8), 1553-1558 ; Soini H.,Musser J.M. «Molecular diagnosis of
mycobacteria» Clin. Chemistry
2001,47(5), 809-814. Наиболее известные сертифицированные тест-системы крупных
международных фирм – Roche
«Amplicor МTB», полуавтоматизированной «Cobas Amplicor» и Gene Probe AMTD хорошо изучены. Они позволяют обнаружить
возбудитель туберкулеза в мокроте в течение 1-2 дней с чувствительностью на
уровне наиболее качественного культурального микробиологического анализа, т.е.
в 75-80% случаев активного туберкулеза легких. Однако, стоимость указанных
тест-систем (20 долларов за 1 анализ) весьма велика, особенно, для российских
потребителей, являющихся бюджетными организациями.
В нашей стране, начиная с 1992 г. также
проведено немалое количество научных исследований. Приказом Минздрава РФ № 64
от 21.02.2000 г. ПЦР утверждена в номенклатуре клинических лабораторных
исследований, в том числе и для выявления микобактерий туберкулеза. В России
были сертифицированы и отечественные наборы реагентов для определения МБТ,
например, набор «Политуб» (НПФ «Литех»).
Однако, в диагностике
туберкулеза ПЦР-анализ используется пока очень мало. Проблемы, рассматриваемые
обычно при решении вопроса о применения ПЦР-анализа связывают с мнением об
«избыточной» чувствительности анализа, приводящей при распространенном
инфицировании населения и возможной внутрилабораторной контаминации продуктами
предшествующих реакций к получению ложноположительных результатов. Трудности
применения связывают также с требованиями трех изолированных помещений, высокой
стоимости, квалификации исполнителей и трудоемкостью анализа.
В современных тест-системах для
предотвращения внутрилабораторной контаминации продуктами предшествующих
реакций – ампликонами с получением замещают дезокситимидинтрифосфат
дезоксиуридинтрифосфатом и используют фермент урацил-ДНК-гликозилазу (УДГ) для
предварительной обработки реакционной системы ПЦР, что позволяет разрушить
возможные контаминирующие ампликоны, содержащие дезоксиуридин вместо
дезокситимидина. Последующее прогревание при 94°С инактивирует фермент УДГ и не препятствует амплификации в
ПЦР. Такая технология позволила уменьшить первоначально очень жесткие
требования к помещениям и технике работы и обеспечила достаточно высокий
(98-99 %) уровень специфичности анализа при исследовании диагностических
материалов пульмонологических пациентов, ранее инфицированных, но не болеющих
туберкулезом.
Таким образом, быстрыми, в рамках 1-2 дней, методами выявления возбудителя туберкулеза в мокроте, как массовом диагностическом материале являются метод флуоресцентной (люминесцентной) микроскопии и ПЦР-анализ.
Применение иммуномагнитных микрочастиц имеет целью повысить эффективность этих лабораторных технологий, уменьшить трудоемкость и повысить безопасность проведения анализа.
Эффективность выявления микобактерий
туберкулеза (МБТ) в мокроте при подготовке образцов для получения мазков с
последующим проведением микроскопии существенно зависит от способа первичной
обработки мокроты, обеспечивающей гомогенность (разжижение) материала при
сохранении жизнеспособности микобактерий, поскольку материал обычно
используется как для микроскопических, так и для культуральных исследований, и
эффективности последующего концентрирования микобактерий в осадке. Наиболее
употребляемым способом гомогенизирования мокроты является кратковременная инкубация
(15-20 мин) в щелочных растворах – 2-4 % NaOH c добавлением или без добавления
N-ацетил-L-цистеина. Затем гомогенизированную мокроту традиционно центрифугируют
в оптимальном режиме при 2500-3000g, что обеспечивает максимальное концентрирование
микобактерий в осадке. Более длительная инкубация материала в щелочных растворах
приводит к уменьшению жизнеспособности микобактериальных клеток и отсутствию
их роста в питательных средах, т.е. к снижению эффективности обнаружения возбудителя.
К такому же результату приводит и недостаточно скоростной режим центрифугирования,
т.к. число микобактерий в осадке и,соответственно, в микроскопируемом мазке
снижается. На практике оптимальные условия подготовки проб мокроты не
соблюдаются из-за одновременного большого числа обрабатываемых материалов и
из-за отсутствия в отечественных лабораториях довольно дорогих центрифуг, позволяющих
обеспечить указанный режим. Кроме того, сама процедура центрифугирования
увеличивает возможность инфицирования атмосферы лаборатории.
Для решения проблем нами был разработан
препарат иммуномагнитных частиц «Микосорб», который состоит из ферромагнитных
частиц размером 2-5 микрон, связанных хелатным методом (патент РФ № 2140084,
1998 г. «Матрица иммуносорбента») с большим количеством белка антител к
микобактериям – иммуноглобулина IgG (80-90 мг на 1г магнитного носителя),
полученного из высокотитражных сывороток кроликов, многократно иммунизированных
инактивированными микобактериями.
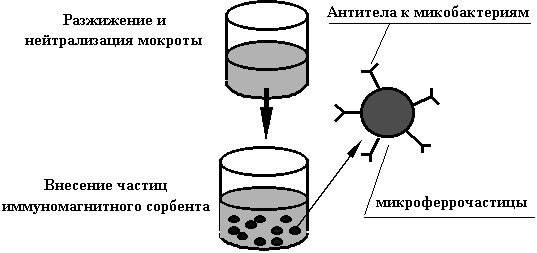
Общая схема применения технологии
иммуномагнитной сепарации из образцов мокроты для выявления микобактерий с
помощью микроскопии и ПЦР-анализа представлена на рисунке 1.
При первичной обработке образцов мокроты
стадию лизиса в щелочной среде завершали нейтрализацией материала добавлением
примерно равного объема 0,5 М раствора
натрия фосфата однозамещенного, содержащего цветной индикатор PH раствора –
феноловый красный. Переход окраски раствора фиксировал его нейтрализацию.
Нейтрализованные образцы мокроты инкубировали с суспензией иммуномагнитных
частиц, после чего осадок исследуемого материала, предназначенный для
люминесцентной микроскопии получали при центрифугировании (в том числе
низкоскоростном – 1000-1500 об/мин) или путем осаждения феррочастиц при 15
минутной инкубации с помощью магнита, помещаемого у дна пробирки. Для
магнитного осаждения мы использовали простейшие штативы для пробирок объемом 50
мл, в которых собирались и обрабатывались образцы мокроты, с вмонтированными в
дно постоянными магнитами (магнитные штативы). Простейшее устройство для
удержания магнитного осадка при декантации материала также было использовано.
Из магнитных осадков готовили мазки, которые фиксировали и окрашивали
аурамин-родамином стандартным методом и определяли с помощью флуоресцентного
микроскопа (использовали отечественный микроскоп типа «Люмам») окрашенные, с
желто-зеленой флуоресценцией палочки размером 2-5 микрон.
Для оценки эффективности предложенного
метода обработки диагностического материала были проведены
клинико-лабораторные испытания, результаты которых отражены в ряде публикаций,
а также контрольные испытания специально разработанного диагностического
набора «Микосорб». Применение
иммуномагнитного сорбента при подготовке осадков для мазков, анализируемых с
помощью флуоресцентной микроскопии, позволило на 20% увеличить число
позитивных результатов и значительно увеличить количество микобактерий,
выявляемых в позитивных мазках по сравнению с контрольным получением осадка
после низкоскоростного центрифугирования, а магнитное осаждение без применения
центрифугирования не уступало эффективности выявления микобактерий с
использованием центрифугирования при 2500g.
Разработана нормативно-техническая
документация на этот набор; в настоящее время проходит его регистрация в
учреждениях Минздрава РФ.
При проведении обработки мокроты для
последующего определения в ней МБТ методом полимеразной цепной реакции (ПЦР)
помимо необходимости эффективного концентрирования возбудителя в осадке,
технология выделения ДНК для анализа в ПЦР является важнейшим фактором его
эффективности.
Хорошо
известные методы фенол-хлороформенной экстракции ДНК из лизированного осадка
мокроты с последующим ее осаждением этанолом из водной фазы или гуанидиновой
обработки с экстракцией ДНК на микропористых частицах стекла являются достаточно
трудоемкими и не дают оптимальных результатов. Дело в том, что в полученных
таким образом образцах ДНК во-первых часто содержатся ингибиторы ПЦР, а
во-вторых количество неспецифической (немикобактериальной) ДНК многократно
превышает возможное количество специфической ДНК. Оба этих фактора значительно
снижают чувствительность специфической амплификации в ПЦР. Кроме того,
присутствие в пробе большого количества неспецифической ДНК часто существенно
затрудняет определение результатов ПЦР при проведении гельэлектрофореза из-за
размазывания («шмера») ДНК на поверхности геля.
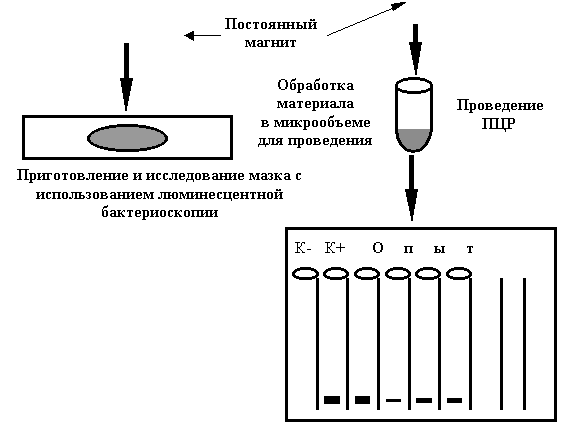
Схема выявления возбудителя
туберкулеза в мокроте с использованием иммуномагнитного
сорбента "МИКОСОРБ"

Для решения этих проблем при
проведении ПЦР-анализа с целью обнаружения микобактерий туберкулеза в пробах
мокроты мы применили ранее разрабатывавшийся нами метод концентрирования
микобактерий из мокроты с помощью магнитных частиц, связанных с антителами к
микобактериям, и использовавшийся для увеличения эффективности их обнаружения
в мазках при люминесцентной микроскопии. Такой метод позволяет провести
селективную сепарацию микобактерий из материала мокроты и использовать их для
проведения ПЦР минуя стадию экстракции ДНК.
При
первичной обработке образцов мокроты стадия лизиса в щелочной среде завершалась
нейтрализацией материала добавлением примерно
равного объема 1 M
трис-гидрохлорида,
приготовленного добавлением 100 мл концентрированной соляной кислоты к 121 г
трис-основания в 900 мл дистиллированной воды и содержащего в качестве цветного
индикатора феноловый красный 40 мг/л.
При нейтрализации образца окраска
переходит от малинового к желтовато-красному. К гомогенизированному и
нейтрализованному материалу мокроты вносили по 100 мкл суспензии
иммуномагнитного сорбента и инкубировали при неинтенсивном перемешивании в
течение 50-60 мин. Затем иммуномагнитные частицы собирали с помощью простого
магнитного устройства (рис. 2), погружаемого на 10-15 мин внутрь пробирки с образцом. Магнитное
устройство состоит из пластикового стержня с закрепленным на конце конусообразным
постоянным магнитом («магнитная палочка»), которая помещается внутрь
стандартного сменного пластикового наконечника (кончик закупорен погружением в
расплавленный парафин) для пипеточного дозатора объемом 1-5 мл. Собранные, при
визуальном наблюдении, на боковых поверхностях пластикового наконечника
магнитные частицы переносили в пробирки Эппендорф объемом 1,5 мл, в которые
предварительно вносили по 0,7 мл нейтрального (PH 7,4) 0,02 М Tris-HCL
буферного раствора. После извлечения «магнитной палочки» собранные частицы
освобождались легким вращением наконечника. Далее частицы центрифугировали
5-10 сек и супернатант отбрасывали.
ПЦР – анализ. К полученным осадкам
иммуномагнитных частиц, содержащим связанные с ними микобактерии, вносили по
20-30 мкл 2% раствора тритона Х-100, микропробирки встряхивали и прогревали
30-40 мин при 95°С. Супернатант использовали в качестве ДНК-содержащего
материала для проведения ПЦР с использованием праймеров Т4 и Т5 (по 15 пикомоль
каждого) для амплифицирования специфического фрагмента инсерционного элемента
IS 6110 (123 н.п.) ДНК микобактерий туберкулезного комплекса. В стандартную
реакционную смесь, содержавшую замену одного из дНТФ (уридиндезокситрифосфат
вместо тимидиндезокситрифосфата), добавляли по 1 ед. урацил-ДНК-гликозилазы
для инактивации возможной контаминации ампликонами. Подготовленную к ПЦР смесь
инкубировали 10 мин при 37°С, а затем проводили реакцию по следующему
протоколу: 1 цикл: 94°С
– 10 мин; 68°С
– 2 мин; 72°С
– 1 мин. Заключительный цикл: 72°С
– 1 мин.
Результаты
амплификации определяли с помощью стандартного агарозного гельэлектрофореза с
окрашиванием флуоресцирующих полос бромистым этидием.
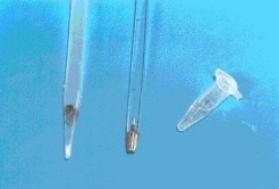
Рисунок 2. Магнитное устройство для переноса
иммуномагнитных частиц из исследуемого образца мокроты в микропробирку для
проведения ПЦР-анализа. Слева направо: пластиковый наконечник, «магнитная
палочка» и пробирка Эппендорф с перенесенными микрочастицами.
Результаты
исследований образцов мокроты методом ПЦР-анализа.
При
исследовании 118 образцов мокроты, полученных от пациентов с неспецифическими
(в основном, пневмония) заболеваниями легких не было выявлено ни одного положительного
результата ПЦР-анализа.
Результаты
исследований образцов мокроты, полученных от 89 больных туберкулезом легких в
начале лечения представлены на таблице 1.
Таблица 1.
Сравнительные результаты выявления МБТ у больных
туберкулезом легких при использовании
пцр-анализа и культивирования
|
Клиническая форма |
Число пациентов |
Положительные
результаты ПЦР-анализа абсол. (%) |
Положительные
результаты культивирования абсол.
(%) |
|
Очаговая +
туберкулома |
10 |
5(50) |
– |
|
Инфильтр. без
распада. |
17 |
12(70,6) |
7(41,2) |
|
Инфильтр. с распадом |
58 |
46(79,3) |
27(46,5) |
|
Фиброзно-кавернозная |
4 |
4 |
4 |
|
Общее число |
89 |
67(75,3) |
36(42,7 |
Представленные
данные свидетельствуют о безусловно более высокой чувствительности
ПЦР-анализа, в среднем 75,3%, по сравнению с культуральным исследованием
(42,7%) при обследовании всех клинических форм туберкулеза легких. При этом наибольшие
различия выявляются при исследовании относительно небольших процессах –
очаговых формах и инфильтративном туберкулезе без распада легочной ткани. При
этих формах чувствительность ПЦР-анализа составила 63% против 25,9% при
традиционном культивировании.
Представленные
материалы демонстрируют, таким образом, большие возможности технологии
иммуномагнитной сепарации микобактерий для повышения эффективности лабораторных
методов диагностики туберкулеза.
2. Разработка и
клигнические испытания тест-системы «Микосорб» для пробоподготовки образцов
мокроты к люминесцентной микроскопии с целью выявления микобактерий.
Быстрое,
с высокой чувствительностью выявление возбудителя туберкулеза в образцах
мокроты полученных при обследовании лиц из групп повышенного риска заболевания
туберкулезом или при подозрении на заболевание туберкулезом является одной из
наиболее актуальных задач фтизиатрии. Флуоресцентная (люминесцентная)
микроскопия мазков, приготовленных из осадков мокроты позволяет выявить
кислотоупорные палочки в качестве предварительного, но достаточно быстрого и
эффективного средства выявления возбудителя туберкулеза.
Эффективность этого метода зависит от достаточного разжижения мокроты и качества осаждения микобактерий в осадках, из которых готовятся мазки. Разработанный Kubica в 1963 г. метод деконтаминации и разжижения мокроты является до настоящего времени общепризнанным как наиболее эффективный. Он состоит в использовании 4 % раствора гидроокиси натрия и 4 % раствора трехзамещенного лимоннокислого натрия (цитрат натрия), смешиваемых в равных объемах с добавлением N-ацетил-L-цистеина из расчета 50-70 мг на образец мокроты. Растворы гидроокиси и цитрата натрия предварительно стерилизуются, ацетил-цистеин добавляется ex tempore. Для эффективного осаждения микобактерий в лизированных образцах мокроты, по материалам большого числа зарубежных исследований, рекомендуется центрифугирование при не менее 2,5-3 тыс. g, т.е. при 4-6 тыс. обор/мин, в зависимости от ротора.
Эти требования, к сожалению, обычно не выдерживается в практических лабораториях, в результате чего чувствительность исследования значительно уменьшается и результативность флуоресцентного (люминесцентного) микроскопического метода выявления микобактерий в российских лабораториях существенно уступает международным данным.
Для решения
этих проблем нами была разработана тест-система «Микосорб», для пробоподготовки
образцов мокроты к люминесцентной микроскопии с целью выявления микобактерий.
Эта тест-система включает в себя реагенты, необходимые для разжижения и
деконтаминации мокроты, т.е. пробоподготовка может проводиться и для
культурального исследования, реагенты для нейтрализации образцов, а также
основной компонент тест-системы – иммуномагнитный сорбент «микосорб» для
связывания микобактерий и их осаждения. Иммуномагнитный сорбент представляет
собой ферромагнитные микрочастицы размером 3-5 микрон, содержащие 20-25 %
оксида кремния, которые связаны с помощью хелатной связи с иммуноглобулином
высокотитражной иммунной сыворотки кроликов, многократно иммунизированных
убитыми микобактериями туберкулеза.
Приготовление
растворов и обработка клинических образцов мокроты
Для проведения подготовки проб готовят следующие растворы реагентов из состава тест-системы:
1. Раствор 4 % гидроксида натрия готовят, растворяя в термостойкой посуде 20 г гидроксида натрия в 500 мл дистиллированной воды.
2. Раствор 0,1 М цитрата натрия готовят, растворяя 20 г трехзамещенного двухводного лимоннокислого натрия в 500 мл дистиллированной воды.
3. Раствор для нейтрализации образца – 78 г натрия фосфорнокислого однозамещенного (двухводный) растворяют в 1 л дистиллированной воды; к 1 л нейтрализующего раствора добавляют в качестве индикатора рН 40 мг фенолового красного, получая после растворения желтое окрашивание раствора.
Раствор
для разжижения мокроты готовят ex tempore,
смешивая равные объемы раствора натрия гидроксида и цитрата натрия, после чего
добавляют сухой порошок N-ацетил-L-цистеина из расчета 50-70
мг на 10 мл приготовленного раствора. Ацетилцистеин можно также добавлять
непосредственно к мокроте из расчета 50-70 мг на 1 образец или больше при очень
вязком образце.
Проведение подготовки проб мокроты
1.
К
мокроте (5-10 мл) добавляют равный объем раствора для разжижения мокроты, перемешивая
исследуемый материал в течение в течение 30-60 секунд. Если мокрота плохо
разжижена, добавить 20-40 мг порошка ацетилцистеина.
2.
Образцы
мокроты нейтрализуют, добавляя равный объем нейтрализующего раствора
фосфорнокислого натрия, содержащего индикатор. При нейтрализации мокроты окраска
раствора переходит от малинового цвета к оранжевому.
3.
К
нейтрализованной мокроте добавляют 0,1 мл суспензии иммуномагнитного сорбента,
перемешанного перед употреблением, и неинтенсивно перемешивают на шейкере в
течение 50-60 минут.
4.
После
инкубации образцов с микрочастицами иммуномагнитного сорбента материал может
быть центрифугирован при 1500-3000 обор/мин в течение 15 минут, либо магнитные
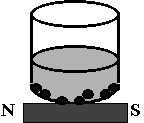
микрочастицы осаждают с помощью постоянного магнита, используя для этого
магнитный штатив в течение 20-30 минут. Магнитный штатив представляет собой
штатив для пробирок объемом 50 мл, в дно которого вмонтированы блоки постоянного
магнита размером 40х40 мм из редкоземельных элементов (самарий-кобальт). Для
получения осадка после магнитного осаждения супернатант удаляют, используя
магнитное устройство для слива.
5.
Полученные
после центрифугирования или магнитного осаждения осадки мокроты размешивают
пипеткой с удлиненным наконечником; 0,1-0,2 мл взвеси наносят равномерно на
предметное стекло готовят мазок, высушивая стекло в сушильном шкафу при 80°С в
течение 1 часа. Окрашивание мазка аурамин-родамином и учет результатов проводят
по стандартной методике (приказ МЗ СССР № 558, 1978 г.).
Проведение и результаты
клинических испытаний тест-системы «Микосорб»
Клинические испытания проводились на базах Московского научно-практического центра борьбы с туберкулезом, Московской туберкулезной больницы №7 и городских противотуберкулезных диспансерах №4 и №15. Испытания проводились по 2-м схемам. В соответствии с 1-й схемой мокроту 66 пациентов собирали дважды в течение 2-х дней подряд. 1-й образец мокроты каждого пациента обрабатывали методом флотации с применением бензольного способа накопления микобактерий по стандартному методу в соответствии с пособием, изложенным в приказе МЗ СССР 1978 г. 2-й образец мокроты обрабатывали с помощью реагентов набора «Микосорб», а именно, мокроту лизировали добавлением смеси равных объемов 4% растворов гидроксида натрия и цитрата натрия с добавлением N-ацетил-L-цистеина, нейтрализовали 0,5 М раствором однозамещенного фосфата натрия, содержащим цветной индикатор нейтрализации феноловый красный и делили эти образцы на 2 равные части. 1 часть каждого такого образца центрифугировали при 3,0 тыс. обор/мин (около 2,5 тыс. g) с помощью отечественной центрифуги ЦАП 3-3,5 («Биофизаппаратура»), после чего из осадков готовили мазки, фиксировали, окрашивали аурамин-родамином стандартным методом и анализировали с использованием люминесцентного микроскопа «Люмам». К каждой 2-й части гомогенизированных и нейтрализованных образцов добавляли иммуносорбент неинтенсивно смешивали 40-50 мин с помощью шейкера, после чего центрифугировали и проводили анализ аналогично описанному выше. Результаты этой части испытаний представлены на следующей таблице 1.
Таблица 1.
|
Диагноз |
Число пациентов |
Флотация |
«Микосорб» |
|
|
Центрифуга |
Центрифуга + иммуносорбент |
|||
|
Очаговый туберкулез л-х |
9 |
0 |
0 |
0 |
|
Инфильтрат. туберкулез л-х |
25 |
6 |
13 |
16 |
|
Диссеминир.+ фибр. каверн. туберкулез л-х |
32 |
19 |
24 |
25 |
|
ВСЕГО |
66 |
25 |
37 |
41 |
Приведенные данные демонстрируют относительно низкую эффективность метода флотации, более наглядную при анализе впервые заболевших пациентов. Например, среди 20 впервые заболевших пациентов с диагнозом инфильтративный туберкулез легких методом флотации микобактерии обнаружены лишь в 3-х случаях, тогда как при оптимальном разжижении и центрифугировании в 10 и 12 (иммуносрбент) случаях. В целом, исходя из результатов этой части испытаний, очевидно, что эффективное разжижение и центрифугирование (при не менее 2,5 тыс. g) образцов мокроты может выявлять микобактерии в не менее 50% случаев активного туберкулеза, а применение иммуносорбента увеличивает эффективность выявления дополнительно на 10%. В большинстве положительных результатов в мазках, полученных при обработке мокроты с использованием иммуномагнитного сорбента выявлялось большее число микобактерий, чем в положительных мазках при обработке мокроты без иммуносорбента.
Другая часть испытаний проводилась в условиях диспансерного и стационарного отделений противотуберкулезных диспансеров №4 и №15. Всего было обследовано 170 пациентов, из которых в ходе комплексного обследования у 106 пациентов установлен активный туберкулез органов дыхания. Обработка образцов мокроты для выявления микобактерий с помощью люминесцентной микроскопии проводилась 2-мя способами: а) с использованием традиционной обработки 10% раствором трехзамещенного фосфата натрия с последующей экспозицией в течение 12 часов и центрифугированием при 1-1,5 тыс. обор/мин; б) пробоподготовка с использованием реагентов набора «Микосорб», включающей разжижение раствором гидроксида и цитрата натрия, с добавлением ацетилцистеина, последующую инкубацию с иммуносорбентом (иммуномагнитные частицы) и центрифугирование в аналогичных условиях (1-1,5 тыс. обор/мин) либо осаждение с помощью магнитного штатива. Результаты этих испытаний представлены на таблице 2.
Таблица 2. Сравнительная эффективность методов
пробоподготовки образцов мокроты для выявления микобактерий методом
люминесцентной микроскопии.
|
Диагноз |
Число пациентов |
Число положительных результатов |
|
|
Традицион. метод |
Набор «Микосорб» |
||
|
Очаговый туб-з л-х |
18 |
1 |
3 |
|
Инфильтрат. туб-з |
54 |
10 |
19 |
|
Диссеминир. туб-з л-х |
18 |
6 |
5 |
|
Хронические формы |
16 |
6 |
7 |
|
ВСЕГО |
106 |
23 |
34 |
Полученные данные демонстрируют, что эффективность выявления микобактерий методом люминесцентной микроскопии у впервые диагностированных больных туберкулезом при использовании эффективной технологии с применением иммуномагнитного сорбента достоверно выше по сравнению с традиционной пробоподготовкой и составила 32 %.
В отдельной серии
экспериментов при исследовании 45 образцов мокроты, полученных от больных
туберкулезом, проводили изучение эффективности обнаружения микобактерий в
мазках при использовании реагентов «Микосорб» с целью сравнения центрифугирования и магнитного осаждения на
магнитном штативе. В обоих случаях мазки готовили из осадков, содержащих
магнитные частицы. Из 45 исследованных образцов при использовании каждого
метода было выявлено по 14 положительных результатов.
Это
свидетельствовало о том, что применение иммуномагнитной технологии может позволить
ликвидировать стадию центрифугирования при обработке образцов мокроты, что,
очевидно, повышает безопасность работы персонала.
При
сравнительном исследовании образцов мокроты 33 пациентов с инфильтративным
туберкулезом легких, получавших специфическую химиотерапию в течение 2-х и
более месяцев, традиционный метод обработки образцов для люминесцентной
микроскопии выявил микобактерии в 6 случаях, что могло бы свидетельствовать об
эффективности проведенного лечения, тогда как пробоподготовка с использованием
набора «Микосорб» позволила выявить микобактерии у этих же пациентов в 16
случаях.
Таким образом, повышение результативности метода люминесцентной микроскопии в качестве быстрого диагностического исследования благодаря использованию новой современной технологии является также существенно важным при контроле за эффективностью специфического лечения туберкулеза.