ИММУНОМАГНИТНЫЕ СОРБЕНТЫ В ОНКОЛОГИИ
Иванов П. К., Голенкина Е. А., Блохин Д. Ю., Ларин М. Ю., Филиппов В. И.
Российский Онкологический Научный Центр имени Н.Н. Блохина РАМН
Российская Федерация, Москва, 115478, Каширское шоссе, дом 24.
Среди используемых в лабораторной и клинической практике методов селекции клеток на сегодняшний день одним из наиболее специфичных и эффективных является иммуномагнитная сепарация (ИМС). Технология ИМС основана на одновременном использовании строгой избирательности взаимодействия моноклональных антител с мембранными антигенами клеток-мишеней и магнитоуправляемости корпускулярных носителей, – магнитных микросфер. Селективно связавшиеся с частицами клетки становятся магниточувствительными и могут быть извлечены из исходной смеси в магнитном поле. Этот нетрудоемкий метод позволяет за короткое время обрабатывать образцы, содержащие до 1010 клеток. Экспериментально показано, что ни микрочастицы, ни процедура сепарации не оказывают существенного влияния на жизнеспособность, морфологию и функциональные качества биологического материала [8].
Практическое значение метода ИМС для онкологии связано, в первую очередь, с использованием магниточувствительных сорбентов при селекции клеток костного мозга, предназначенного для трансплантации. Лечение высокоэффективными противоопухолевыми препаратами позволяет сохранить жизнь больным, которые раньше считались неизлечимыми. Однако цитотоксичность, лежащая в основе противоопухолевого действия этих препаратов, одновременно является и основным ограничением их применения. От побочных эффектов химиотерапии в первую очередь страдают молодые, активно делящиеся клетки. Наиболее серьезные осложнения связаны с гибелью стволовых гемопоэтических клеток костного мозга, что проявляется в прогрессирующей потере иммунитета, нарушении гомеостаза и анемии. Подобная картина наблюдается и при облучении организма высокими дозами ионизирующих излучений в результате радиотерапии.
Наиболее действенным способом восстановления кроветворных функций организма служит трансплантация аллогенных (донорских) или аутологичных (собственных клеток больного, взятых до лечения и сохраняемых в жизнеспособном состоянии в условиях глубокого холода) гемопоэтических клеток костного мозга или периферической крови. Тем не менее, существует ряд причин, по которым эта процедура далеко не всегда приводит к желаемому терапевтическому эффекту. Трансплантация аутологичного материала сопряжена с риском развития рецидивов заболевания из-за возможной контаминации трансплантата опухолевыми клетками [2]. При пересадке костного мозга от доноров возникает проблема развития реакции «трансплантат-против-хозяина» (РТПХ), связанная с гистологической несовместимостью донора и реципиента. Предварительная сепарация трансплантата, приводящая к удалению нежелательных клеток (опухолевых, аллореактивных), решает возникающие проблемы, увеличивая вероятность успеха как аутологичной, так и аллогенной трансплантации.
В клинической практике находят применение два принципиально различных метода пред-трансплантационного разделения гемопоэтических клеток: позитивная и негативная селекция материала. С помощью позитивной селекции (обогащения) получают чистые фракции CD34+-стволовых кроветворных клеток (СКК). Использование СКК, как альтернативы введению цельного костного мозга при аутологичной трансплантации, сводит к минимуму риск повторного заражения пациента опухолевыми клетками и упрощает криоконсервацию материала [6]. Быстрое восстановление гемопоэза и снижение частоты рецидивов было показано при трансплантации аутогенных СКК больным раком молочной железы, нейробластомой [5], В-клеточными лимфомами [9]. Обнадеживающие результаты получены при трансплантации аллогенных стволовых клеток детям, страдающим острым и хроническим миелолейкозом, лимфолейкозом, врожденным иммунодефицитом. Клинические испытания показали отсутствие каких-либо побочных эффектов, связанных с возможным присутствием в CD34+-трансплантатах остаточных количеств материалов и реагентов, используемых при селекции.
Выделяемые методом ИМС CD34+-предшественники гемопоэза могут использоваться для трансфекции при создании генно-инженерных вакцин, применяемых в терапии онкологических и генетических заболеваний [7, 8, 13, 14]. Магнитоуправляемые сорбенты могут оказаться крайне полезными и при получении противоопухолевых вакцин на основе дендритных клеток.
Негативная селекция (деплеция) аутологичных клеток применяется для прямой очистки от микрометастазов и позволяет в сотни раз сократить количество опухолевых клеток в костном мозге больных как с солидными (нейробластома), так и с лимфопролиферативными (В-клеточные лимфомы) заболеваниями. В случае аллогенной трансплантации негативная селекция иммунокомпетентных клеток (Т-лимфоцитов) способствует предотвращению развития острой РТПХ. На сегодняшний день в мире не существует однозначного мнения относительно целесообразности полной деплеции Т-клеток. Клинические исследования показывают, что удаление всех Т-лимфоцитов делает невозможным успешное приживление трансплантата [3]. Кроме того, присутствие в трансплантате иммунокомпетентных клеток играет ключевую роль в развитии реакции «трансплантат-против-опухоли». Эти факты побудили поиск подходов к частичной элиминации Т-клеток. Некоторые из разработанных методов предварительной селекции трансплантатов, например, удаление CD4+-хелперных клеток с частичным истощением популяции цитотоксических CD8+-лимфоцитов [5]; деплеция по антигену CD6 [7, 9], уже проходят клинические испытания. Другие, такие как культивирование клеток реципиента с клетками донора и последующая деплеция активированных клеток по мембранному рецептору CD25, находятся в стадии лабораторных исследований [4].
Целью настоящей работы явилось создание иммуномагнитных сорбентов и системы для селекции клеток костного мозга перед аутологичной и аллогенной трансплантацией.
Первым этапом работы стало получение магнитоуправляемых полистирольных микросфер (МПМ). Эта работа проводилась совместно с Институтом биохимической физики РАН (г. Москва) и ЦНИИ Точного машиностроения (г. Климовск). Магнитные микросферы получали методом эмульсионной полимеризации из сополимеров (стирол, дивинилбензол) и коллоида магнетита (Fe3O4) на основе органических растворителей.
Основные характеристики полученных частиц приведены в таблице 1. Разработанная методика позволяет синтезировать сферические частицы с гомогенностью распределения по размерам не менее 96 % с функционально-активными поверхностными группами (СООН-, ОН-, NH2-) для последующего конъюгирования с векторными молекулами. Незначительная остаточная намагниченность предупреждает их спонтанное агрегирование в суспензии. Высокая магниточувствительность позволяет легко концентрировать микросферы в неоднородных магнитных полях доступной напряженности (1500 – 2000 Э). По физико-химическим свойствам синтезированные микросферы полностью удовлетворяют всем требованиям, предъявляемым к мелкодисперсным носителям, и могут быть использованы при создании магнитоуправляемых сорбентов для сепарации клеток и субклеточных структур.
Таблица 1. Характеристики полистироловых магнитных микросфер.
|
Средний диаметр частиц, мкм |
Содержание магнетита, % |
Намагниченность насыщения, e.m.u./g |
Остаточная намагниченность, e.m.u./g |
|
0,8 |
25 |
14 |
0,1 |
В соответствии с целью работы, в качестве векторных молекул при создании иммуномагнитных конъюгатов были использованы моноклональные антитела против мембранных антигенов гемопоэтических клеток человека, представленные в таблице 2.
Таблица 2.
Моноклональные антитела, использованные при создании иммуномагнитных конъюгатов
|
МКА, клон |
Антиген/ клетка-мишень |
|
ICO-90 |
CD3/ Т-лимфоциты, все субпопуляции |
|
ICO-31 |
CD8/ Т-лимфоциты, цитотоксические |
|
ICO-86 |
CD4/ Т-лимфоциты, хелперные |
|
ICO-180 |
CD20/ В-лимфоциты, все субпопуляции |
|
ICO-115 |
CD34/ гемопоэтические стволовые клетки |
Для активации поверхностных ОН-групп и обеспечения ковалентного связывания иммуноглобулинов непосредственно перед конъюгированием частицы обрабатывали п-толуолсульфонилхлоридом (500 мкг на 1 г фазы).
Для определения оптимальных условий получения иммуноспецифических конъюгатов исследовали влияние на эффективность связывания состава, молярности и кислотности посадочных буферных растворов, а также ультразвуковой обработки. При прочих равных условиях (инкубация с белком в течение 12 часов при 4оС с постоянным перемешиванием) сорбционная емкость магнитных микросфер (S), определяемая как количество связанного белка (мкг) на единицу массы носителя (мг), была максимальной при использовании 0,015М PBS (pH 7.4). Ультразвуковая обработка, проводимая через 3 часа после начала инкубации для разобщения возможных агрегатов и более равномерной иммобилизации протеинов, не оказала существенного влияния на сорбционную емкость частиц. Более того, позднее было показано, воздействие ультразвуком отрицательно сказывается на аффинности антител.
Ранее нами было продемонстрировано [1], что величина сорбционной емкости является важной характеристикой иммуномагнитных конъюгатов, заметно влияющей на эффективность сепарации. Согласно данным литературы и результатам собственных исследований, оптимальное значение S соответствует образованию поверхностного протеинового монослоя и может быть рассчитано по формуле:
S = 6 . C / ρ . D,
где С – параметр, равный для иммуноглобулинов 2,5 мг/м2; D– диаметр микрочастиц, мкм;
ρ – плотность микрочастиц, г/см3.
Для используемых магнитных микросфер (D=0,8 мкм; ρ=1,09 мг/см3) эта величина равна 17 мкг/мг. Изучив динамику связывания антител с носителем, определили, что для получения конъюгатов с указанной сорбционной емкостью, время инкубации должно составлять 6 часов для МКА ICO-180 10 – 12 часов для МКА ICO-31, ICO-86, ICO-90 и ICO-115.
После инкубации с МКА для предупреждения неспецифического взаимодействия частиц с клетками свободные сайты связывания белков блокировали человеческим сывороточным альбумином. До использования готовые конъюгаты хранили в 0,01 М PBS с добавлением 0,5 % ЧСА и 0,1 % NaN3.
Материалом для селекции служили мононуклеарные клетки периферической крови здоровых доноров, выделенные в градиенте плотности фиколл-верографина. При тестировании сорбента ИМС-ICO-115 также использовались искусственные смеси клеточных линий.
Непосредственно перед селекцией магнитные микросферы дважды отмывали рабочим раствором (2mM EDTA, 0,5 % ЧСА в 0,01М PBS (рН 7.4)). Исходные клетки суспендировали в том же растворе и добавляли к сконцентрированным в пластиковой пробирке частицам. Инкубацию проводили в течение 30 мин при постоянной ротации. Температурные условия инкубации подбирали экспериментально, определяя эффективность сепарации в температурном диапазоне от 4оС до 22оС. Для разделения образец помещали в неоднородное магнитное поле постоянного магнита из сплава кобальт-самарий на 7-10 мин, концентрируя связавшиеся с частицами сорбента клетки (позитивная фракция) в виде узкой полосы на стенке пробирки, и осторожно отбирали супернатант (негативная фракция). Клетки позитивной фракции затем ресуспендировали в 0,01М PBS и вновь концентрировали в магнитном поле. Процедуру отмывки, необходимую для того, чтобы исключить вероятность случайного попадания в позитивную фракцию свободных клеток, проводили трижды. Для определения эффективности негативной селекции проводили фенотипирование клеток исходного образца и клеток, не связавшихся с частицами, иммунофлуоресцентным методом с последующей обработкой результатов на проточном цитофлуориметре (FACScan, Becton Dickinson).
Негативная селекция Т-лимфоцитов.
Для негативной селекции (деплеции) Т-лимфоцитов использовали иммуномагнитные сорбенты против антигенов CD3 (МПМ-ICO-90), CD4 (МПМ-ICO-86) и CD8 (МПМ-ICO-31).
В случае селекции по антигенам CD4 и CD8 было показано, что проведение инкубации при 13оС обеспечивает наиболее полное удаление клеток-мишеней. Эффективность селекции в этих условиях составляет 96 % и 98 % для МПМ-ICO-86 и МПМ-ICO-31, соответственно (рис. 1, 2). Повышение температуры незначительно ухудшает качество разделения (до 85 % и 87 %, соответственно). При снижении температуры эффективность деплеции резко падает и при 4 оС составляет 20 % и 28 % для CD4+- и CD8+-лимфоцитов.
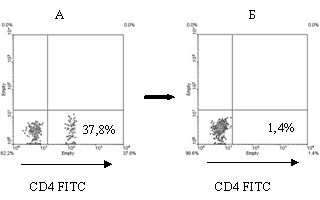 |
Рисунок 1. Эффективность негативной селекции Т-лимфоцитов по антигену CD4
Двухмерные гистограммы иммунофлуоресценции мононуклеарных клеток периферической крови здорового донора до (А) и после (Б) негативной селекции. Клетки окрашены МКА анти-CD4 FITC.
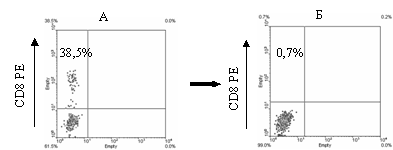 |
Рисунок 2. Эффективность негативной селекции Т-лимфоцитов по антигену CD8
Двухмерные гистограммы иммунофлуоресценции мононуклеарных клеток периферической крови здорового донора до (А) и после (Б) негативной селекции. Клетки окрашены МКА анти-CD8 PE.
Мембранный рецептор CD3, экспрессированный на всех субпопуляциях Т-лимфоцитов, является самой удобной мишенью для осуществления тотальной деплеции Т-клеток. Однако этот антиген оказался и наиболее сложным объектом при проведении иммуномагнитной селекции. На эффективность деплеции CD3+-лимфоцитов существенно влияют и сорбционная емкость микросфер, и температурный режим проведения сепарации. Ранее было показано [1], что сорбционная емкость конъюгата анти-CD3 должна строго соответствовать оптимальному значению, уменьшение или увеличение количества связанных МКА приводит к резкому снижению качества разделения. В отличие всех остальных полученных и экспериментально проверенных нами конъюгатов, в случае негативной селекции по антигену CD3 оптимальной оказалась температура инкубации клеток с микросферами 4оС. Проведение инкубации на холоду обеспечивает удаление 72 % клеток-мишеней. Повышение температуры сокращает долю удаленных Т-лимфоцитов до 60 % (13оС) и до 40 % (22оС).
Сравнительно низкий уровень деплеции CD3-положительных клеток обусловлен, скорее всего, особенностями самого антигена. Можно предположить, что взаимодействие иммуноглобулина, иммобилизованного на магнитной матрице, с CD3-рецептором Т-лимфоцита либо вызывает изменение конформации молекулы МКА, либо сопровождается поглощением МКА клеткой вследствие интернализации самого антигена. Это приводит к разрыву связи между МКА и магнитным носителем и освобождению клетки-мишени, которая с этого момента становится «невидимой» для частиц сорбента. Стабилизации конъюгатов и, следовательно, повышению эффективности селекции, отчасти способствует понижение температуры. Однако, даже проведение инкубации при 4оС, не приводит к полному удалению CD3+-клеток. Другой возможный подход к устранению возникшей проблемы заключается в создании так называемых «универсальных» конъюгатов, несущих на поверхности спейсерные участки для связывания МКА. Увеличение расстояния между молекулой антитела и поверхностью магнитной частицы должно способствовать сохранению связи между клеткой и микросферой при интернализации антигена. Нами был получен конъюгат магнитных микросфер с поликлональными антителами барана против Fc-фрагментов IgG мыши. Для направленного разделения сорбент инкубировали с клетками, предварительно мечеными моноклональными антителами. Использование полученного конъюгата в сочетании с МКА анти-CD3 привело к удалению 95 % Т-лимфоцитов (рис. 3).
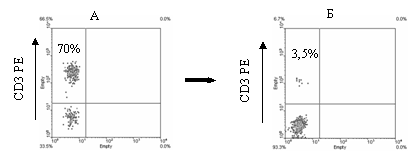 |
Рисунок 3. Эффективность негативной селекции Т-лимфоцитов по антигену CD3
Двухмерные гистограммы иммунофлуоресценции мононуклеарных клеток периферической крови здорового донора до (А) и после (Б) негативной селекции. Клетки окрашены МКА анти-CD3 PE.
Негативная селекция В-лимфоцитов.
Для направленного удаления В-лимфоцитов по мембранному антигену CD20 использовали иммуномагнитный конъюгат МПМ-ICO-180. Эффективность сепарации составляла 95-97 % при проведении инкубации в диапазоне температур от 13 до 22оС. Более низкие температуры, как и в случае селекции по антигенам CD4 и CD8, отрицательно сказывались на качестве разделения, при 4оС уровень деплеции не превышал 30 %.
Выделение гемопоэтических стволовых клеток.
Селекцию CD34+-клеток с помощью МПМ-ICO-115 проводили на искусственных смесях клеточных линий KG1 и JY с различным содержанием CD34+-клеток. Независимо от доли антиген-позитивных клеток в образце использование разработанной методики и сорбента позволяет достичь почти 100 %-ной элиминации CD34+-клеток линии KG1 (рис. 4).
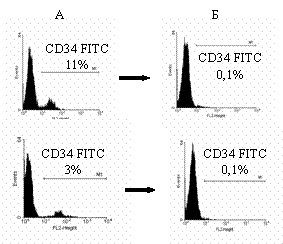
Рисунок 4. Эффективность негативной селекции CD34+-клеток перевиваемой клеточной линии KG1 из смесей клеточных линий KG1 и JY
Гистограммы иммунофлуоресценции клеток до (А) и после (Б) негативной селекции. Клетки окрашены МКА анти-CD34 FITC.
Аналогичные результаты были получены и при извлечении CD34+-клеток из периферической крови больного хроническим миелоидным лейкозом в стадии бластного криза В исходном образце мононуклеарных клеток содержание CD34+-гемопоэтических предшественников составляло 80 %. После селекции антиген-положительные клетки в популяции не выявлялись.
Чтобы дополнительно удостовериться в строгой избирательности связывания иммуномагнитных микросфер, МПМ-ICO-115 инкубировали с мононуклеарными клетками периферической крови здоровых доноров, где содержание CD34+-клеток не превышает 1 %. Специфичность связывания составила более 98 %.
В результате проведенных исследований была разработана технология синтеза полистироловых одноразмерных магнетитовых микросфер со средним диаметром 0,8 мкм. Намагниченность насыщения МПМ составляет 14 e.m.u./g, остаточная намагниченность не превышает 0,1 e.m.u./g. Показана возможность использования микросфер в качестве универсальной матрицы при создании иммуноспецифических магнитоуправляемых конъюгатов. На основе моноклональных антител ICO-90, ICO-31, ICO-86, ICO-180 и ICO-115 получены иммуномагнитные сорбенты, которые специфически взаимодействуют с Т-лимфоцитами (CD3+, CD8+, CD4+), В-лимфоцитамии (CD20+) и гемопоэтическими стволовыми клетками (CD34+) человека в системах in vitro. Экспериментально показано, что разделение гетерогенных клеточных популяций с помощью МПМ-ICO-90, МПМ-ICO-31, МПМ-ICO-86, МПМ-ICO-180 и МПМ-ICO-115 приводит к селективному удалению 95-98 % антиген-позитивных клеток.
Предполагаемое клиническое применение полученных сорбентов, в первую очередь, связано с сепарацией клеток костного мозга, предназначенного для трансплантации онкологическим больным.
Негативная иммуномагнитная селекция с использованием ИМС на основе МКА ICO-90, ICO-31, ICO-86 и ICO-180 может быть использована для элиминации опухолевых клеток из костного мозга больных Т- и В-клеточными лимфомами перед аутологичной трансплантацией. Иммуномагнитное истощение Т-клеточной популяции донорского костного мозга может стать способом предотвращения развития реакции “трансплантат-против-хозяина”. Экспериментально показанная эффективность сепарации CD34+-клеток с помощью МПМ-ICO-115 открывает перспективу дальнейшего применения этого конъюгата для получения чистых популяций стволовых кроветворных клеток методом позитивной селекции. Созданные сорбенты могут использоваться и при получении дендритных клеток для создания противоопухолевых вакцин.
Универсальность сорбентов и технологии сепарации позволяет предположить, что разработанный метод найдет широкое научно-исследовательское и клиническое применение.
Список литературы:
1. Иванов П. К. Моноклональные антитела в онкологии. // Автореф. дисс…докт. мед. наук., Москва, 2001.
2. Brockstein B., Ross A., Hollingsworth K. et al. Tumour cell contamination of bone marrow harvest products: clinical consequences in a cohort of advanced breast cancer patients undergoing high dose chemotherapy (HDS). // Proc. Am. Soc. Clin. Oncol., 1995, 14, 327.
3. Chakraverty R., Robinson S., Peggs K. et al. Excessive T cell depletion of peripheral blood stem cells has an adverse effect upon outcome following allogeneic stem cell transplantation. // Bone Marrow Transplant., 2001, 28, № 9, p. 827–834.
4. Garderet L., Snell V., Przepiorka D. et al. Effective depletion of alloreactive lymphocytes from peripheral blood mononuclear preparations. // Transplantation, 1999, 67, № 1, p. 124–130.
5. Handgretinger R., Greil J., Schirmann U., Lang P., Gonsalez-Ramella O., Schmidt I., 6. Niethammer D., Klingebiel T. Positive selection and transplantation of CD34+ progenitor cells: feasibility and purging efficacy in pediatric patients with neuroblastoma. // J. Hematother., 1997, 6:3, 235-242.
6. Herrera C., Torres A., Garcia-Castellano J. M. et al. Prevention of graft-versus-host disease in high risk patients by depletion of CD4+ and reduction of CD8+ lymphocytes in the marrow graft. // Bone Marrow Transplant., 1999, 23, № 5, p. 443 – 450.
7. Karlsson S., Correll P.H., Xu L. Gene transfer and bone marrow transplantation with special reference to Gaucher’s disease. // Bone Marrow Transplant., 1993, 1, 124.
8. O’Shaughnessy J.A., Cowan K.H., Nienhuis A.W., McDonagh K.T. et al. Retroviral mediated transfer of the human MDR-1 gene into hematopoieticstem cells during autologous transplantation after intensive chemotherapy for metastatic breast cancer. // Hum. Gene Ther., 1994, 5, 891.
9. Ogura M., Kagami Y., Suzuki R. et al. Phase I/II trial of cure-oriented high-dose chemoradiotherapy with transplantation of CD34+ peripheral blood cells purified by the immunomagnetic bead method for refractory hematological malignancies. // Cancer Chemother. Pharmacol., 1997, 40 Suppl., p. 51 – 57.
10. Sao H., Kitaori K., Kasai M. et al. A new marrow T cell depletion method using anti-CD6 monoclonal antibody-conjugated magnetic beads and its clinical application for prevention of acute graft-vs.-host disease in allogeneic bone marrow transplantation: results of a phase I-II trial. // Int. J. Hematol., 1999, 69, № 1, p. 27 – 35.
11. Servida F., Soligo D., Caneva L. et al. Functional and morphological characterization of immunomagnetically selected CD34+ hematopoietic progenitor cells. // Stem. Cells, 1996, 14, № 4, 430 – 438.
12. Soiffer R.. J., Weller E., Aliea E. P. et al. CD6+ donor marrow T-cell depletion as the sole form of graft-versus-host disease prophylaxis in patients undergoing allogeneic bone marrow transplant from unrelated donors. // J. Clin. Oncol., 2001, 19, № 4, p. 1152–1159.
13. Ward M., Richardson C., Pioli P., Smith L., Podda S., Goff S. et al. Transfer and expression of the human multiple drug resistance gene in human CD34+ cells. // Blood, 1994, 84, 1408.
14. Xu L., Stahl S.K., Dave H.P., Schiffmann R., Correll P.H. et al. Correction of the enzyme deficiency in hematopoietic cells of Gaucher patients using a clinically acceptable retroviral supernatant transduction protocol. // Exp. Hematol., 1994, 22, 223.