ИНДУКТОР ВЫСОКОЧАСТОТНЫХ КОЛЕБАНИЙ ДЛЯ ГИПЕРТЕРМИИ И МАГНИТОСЕНСИБИЛИЗАЦИИ ОПУХОЛЕЙ МАГНИТНЫМИ ЖИДКОСТЯМИ
Брусенцов Н. А. 1, Байбуртский Ф. С. 2, Шумаков Л. И. 3,
Брусенцова Т. Н. 4, Полянский В. А. 5, Холопов В. Л. 5.
1. Российский онкологический научный центр имени Н.Н. Блохина, РАМН,
г. Москва. E – mail: Brusentsov2005@yandex.ru, pogodins@mtu-net.ru
2. Институт биохимической физики имени Н. М. Эмануэля, РАН
г. Москва. E – mail: Chembio@sky.chph.ras.ru, Bayburt@mail.ru
3. Всероссийский научно-исследовательский институт радиотехники,
г. Москва. Факс: 261 – 29 – 33
4. Российский химико-технологический университет им. Д.И. Менделеева,
г. Москва. E – mail: Gala752@mail.ru
5. Институт механики МГУ имени М. В. Ломоносова,
г. Москва. E – mail: pol@imec.msu.ru
Авторами разрабатываются устройства и препараты для диагностики и терапии онкологических заболеваний, феррижидкости (ФЖ) на основе декстранферрита (ДФ) [1-3]. Ферримагнитные кристаллы полученных ФЖ трансформируют энергию переменного магнитного поля (ПМП) в теплоту посредством различных энергетических потерь и т.о. вызывают нагревание в зоне своего заключения. Скорость нагревания ФЖ в переменном магнитном поле, а значит и их удельная абсорбция энергии (УАЭ) зависят от размеров кристаллов, их структуры и состава [1-3, 4]. Совпадение кривых размагничивания после снятия магнитного поля с МЖ при температурах 77 и 293 К подтверждает предположение, что процесс релаксации намагниченности МЖ связан в основном с вращением магнитных моментов внутри частиц, этим объясняется высокая скорость нагрева однодоменных частиц магнетита.
Нерешенной технической проблемой фотодинамической терапии (ФДТ) является небольшая глубина (0,1-0,3 см) ткани тела, на которой свет инициирует фотосенсибилизирующий агент [1, 5,6], в то же время полная гибель опухолевых клеток, вызванная ДФ-индукционной гипертермией, наблюдалась только при относительно высоких дозах ДФ [1, 3, 4, 7].
Целями этой работы явились: испытания индуктора ПМП при оценке влияния на клетки и опухоли фотогем-содержащих декстранферритовых феррижидкостей при комбинации фотогем-магнито-ДФ-термосенсибилизации (ФГ-М-ДФ-ТС) опухолевых клеток в разработанном нами индукторе; определение комбинированного влияния переменного магнитного поля и гипертермии на гибель и лизис клеток, в присутствии фотогема, для дальнейшего проникновения в механизмы этих процессов.
Исследованы 5 водных декстранферритовых феррижидкостей (ФЖ) %: 12.0; 0.6; 0.2; 0.02 и 0.002, которые были получены по модифицированной нами методике [3].
Определили выживаемость клеток CaOv и P388 как результат их экспозиции при различных температурах и концентрациях ДФ, фотогема (ФГ) и гистидина (Гис); декстранферрита в комбинации с фотогемом (ДФ+ФГ) и фотогема в комбинации с гистидином (ФГ+Гис).
Изучили темновую магнито [5] -термосенсибилизацию [6] опухолевых клеток декстранферритовыми феррижидкостями (ДФФЖ), содержащими фотогем, достигаемую одновременно действием переменного магнитного поля или нагревом в проточном термостате.
Переменное магнитное поле 0.88 МГц, 9.3 кА/м, 0,15 кВт достигалось внутри индукционной катушки, охлаждаемой водой, диаметр 9 см (20 витков с расстоянием между витками 0,9 см).
Опухолевые клетки (концентрация 106 клеток/мл) и опухолевые клетки совместно с реагентами: ДФ, ФГ, Гис, ФГ+ДФ, ФГ+Гис помещали в центр катушки и выдерживали 30 мин в переменном магнитном поле в темноте. В 6 пробирок (ПП), содержащих по 2 мл суспензии клеток свежего перитонеального асцитического лимфолейкоза Р388 или суспензии клеток СаОv в концентрации (2х106/мл), прибавили: в первую пробирку (П) – 2 мл 12% (вес/объем) ДФФЖ (вес g-Fe2O3 60 мг); во вторую – 2 мл 0,6% ДФФЖ; в третью – 2 мл 0,2% ДФФЖ; в четвертую – 2 мл 0,02% ДФФЖ; в пятую – 2 мл 0,002% ДФФЖ; в шестую (контрольную П) – 2 мл 0,9% раствора NaCl. Затем ПП выдерживали в переменном магнитном поле, как описано выше, и поддерживали определенную температуру от +37 до +44°C в течение 30 минут (Рисунок 1). Измерение температуры клеток во время их обработки переменным магнитным полем проводили спиртовым термометром. Альтернативно, клетки в присутствии ФГ, Гис, ФГ+ДФ, ФГ+Гис, в контрольных пробирках, инкубировали при +37°C в лабораторном термостате в темноте. В шесть изолированных пробирок, содержащих по 0,1 мл свежих Р388 или СаОv клеток (2х106/мл) прибавили по 0,1 мл, перечисленных выше реагентов, (Рисунки 3-5); в шестую (контрольную пробирку, Рисунки 1,2) прибавили 0,1 мл 0,9% раствора NaCl. Объем реакционной смеси в пробирках, содержащих опухолевые клетки и реагенты, 4 мл (Рисунок 1) и 0,2 мл (Рисунки 2-6), концентрация клеток во всех пробирках 106 клеток/мл. Температура реакционной смеси от +37 до +41°C достигалась проточным термостатом (Рисунки 3,5). Температура реакционной смеси от 37 до 44°C (Рисунок 1), +37°C (Рисунок 2) и от +37 до +41°C (Рисунки 4,6) достигалась действием переменного магнитного поля. Выживаемость клеток Р388 и СаОv определяли как результат экспозиции при различных концентрациях ДФ, ФГ, Гис, ФГ+ДФ и ФГ+Гис при температурах +37 и +41°C в процессе ФГ- магнито- и термосенсибилизации (ФГ-М-ТС), достигаемой в переменном магнитном поле в темноте. Выживаемость клеток CaOv или P388 анализировали подсчетом на гемоцитометре после экспозиции клеток в различных условиях в переменном магнитном поле с ДФФЖ, ФГ, ФГ+ДФ, ФГ+Гис. Взаимодействие ДФ с клетками изучали принимая во внимание рекомендации приведенные в [8]. Результаты представляют средние значения (±SD), полученные в 4 независимых опытах c учетом рекомендаций приведенных в [9].
Температура в пробирках 1-6 была пропорциональна концентрации ДФ. Фракции мертвых клеток были пропорциональны концентрации ДФ: фракция выживших клеток при температуре от 37 до 41оС (ПП 4-6) была высокой, при 42-43оС – (ПП 2, 3) – незначительной, и при 43-44оС (П. 6) – отсутствовала. Таким образом, наблюдалась ДФ-термосенсибилизация опухолевых клеток.
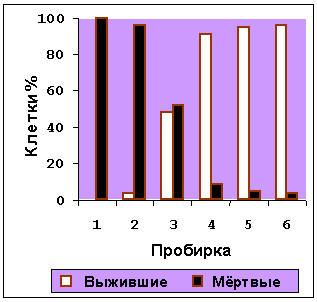

Рисунок 1. Влияние декстранферрита (ДФ) на выживаемость клеток
CaOv и P388 при экспозиции 30 мин в ПерМП.
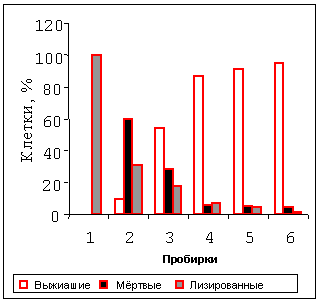
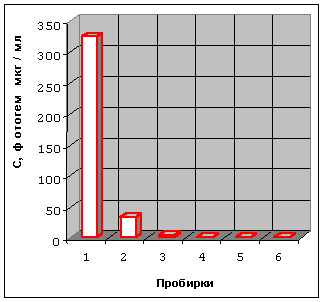
Рисунок 2. Влияние фотогема (ФГ) на выживаемость клеток CaOv
при экспозиции 30 минут в электромагнитном поле при +37оС.
На рисунке 2 представлена цитотоксичность ФГ, полученная при магнитной сенсибилизации при +37оС в течение 30 минут: величины фракций лизированных и мертвых клеток при умеренных концентрациях ФГ оказались неожиданно высокими. При низких концентрациях ФГ и +37оС фракции выживших клеток были значительными. Таким образом, наблюдалась ФГ-магнитосенсибилизация опухолевых клеток.
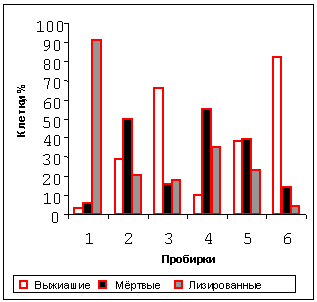
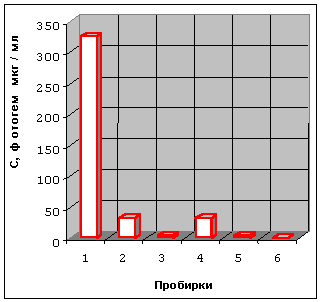
Рисунок 3. Влияние ФГ на выживаемость клеток CaOv при экспозиции 30 минут в
проточном термостате при +37оС (Пробирки 1-3) и при +41оС (Пробирки 4-6).
На рисунке 3 представлена цитотоксичность, зависящая от термосенсибилизации при повышении температуры от +37оС до +41оС в течение 30 минут. Фракции лизированных и мертвых клеток были пропорциональны концентрации ФГ и увеличивались с повышением температуры. Фракции выживших клеток при +37оС и концентрации ФГ 325 мкг/мл и при 41оС при концентрации ФГ 32,5 мкг/мл были незначительными. Т.о., в результате ФГ-магнито-термосенсибилизации опухолевых клеток число лизированных и мертвых клеток повышается от 3 до 10 раз. Т.о., наблюдалась ФГ-магнито-термосенсибилизация опухолевых клеток.
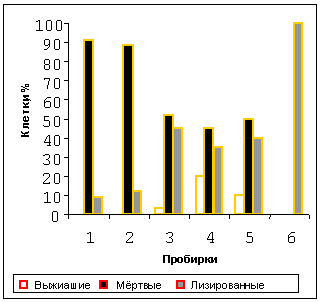
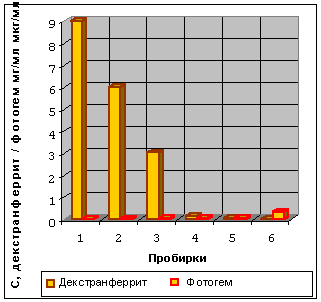
Рисунок 4. Влияние ДФ и ФГ на клетки CaOv при экспозиции в электромагнитном поле
30 минут при температуре от +41 дo +43оС (ПП 1-3) и при +37оС (Пробирки 4-6).
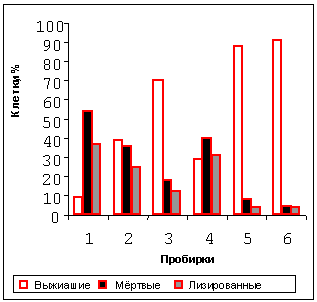
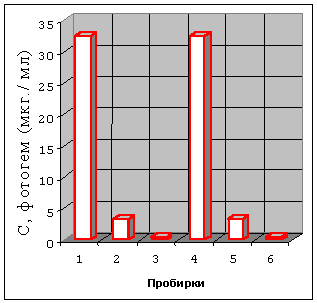
Рисунок 5. Влияние ФГ на выживаемость клеток Р388 при экспозиции 30 минут
в проточном термостате при +41оС (Пробирки 1-3) и при +37оС (Пробирки 4-6)
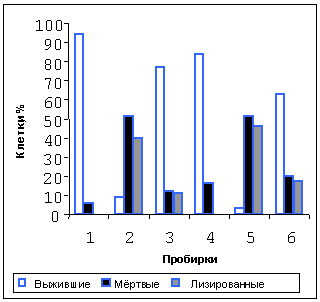
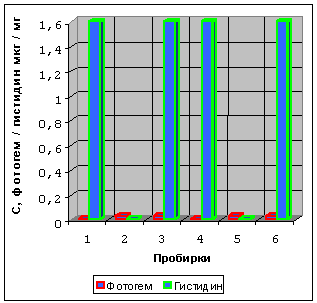
Рисунок 6. Влияние ФГ и гистидина на клетки P388 при экспозиции
в электромагнитном поле 30 мин при +37оC (пробирки 1-3) и при +41оС (пробирки 4-6).
На рисунке 4 показана цитотоксичность комбинации ФГ+ДФ, проявившаяся при температуре от +41 до +43ºC и при +37ºC через 30 минут; фракции лизированных и мертвых клеток были пропорциональны концентрациям ФГ и ДФ. Результатом комбинации магнитосенсибилизации и термосенсибилизации при умеренных концентрациях ФГ (0,8-32,5 мкг/мл) и при высоких концентрациях ДФ (3-9 мг/мл) явилось отсутствие фракции выживших клеток; при умеренных концентрациях ФГ (3,25-32,5 мкг/мл) и при низких концентрациях ДФ (0,001-0,1 мг/мл) фракция выживших клеток была умеренной; при высокой концентрации ФГ (325 мкг/мл) и низкой концентрации ДФ фракция выживших клеток отсутствовала. Таким образом, наблюдалась ФГ-магнито-ДФ-термосенсибилизация опухолевых клеток.
На рисунке 5 представлена цитотоксичность ФГ, полученная при инкубации клеток Р388 при 41 и 37ºС в течение 30 мин: фракции лизированных и мертвых клеток были пропорциональны концентрации ФГ и температуре суспензии. Результатом комбинированного действия магнито- и термосенсибилизации при умеренных концентрациях ФГ (0,8-32,5 мкг/мл) при температуре от +41оС до +43оC является отсутствие фракции выживших клеток. При умеренных концентрациях ФГ и +37 оС фракции выживших клеток были умеренными. Таким образом, наблюдалась ФГ-магнито-термосенсибилизация опухолевых клеток.
Мы изучили роль: только ДФ, ФГ, Гис, ФГ+ДФ, ФГ+Гис; гипертермии, электромагнитного поля, индукционной гипертермии в электромагнитном поле; ФГ магнито- и термосенсибилизации в темноте, с целью усиления разрушения опухолевых клеток. Два типа опухолевых клеток: адаптированной карциномы яичников человека (карцинома оварии, CaOv) и мышиного асцитического лимфолейкоза Р388 инкубировали в присутствии или без упомянутых реагентов и физических факторов. Их последовательно нагревали от +41 до 44оС и обрабатывали электромагнитным полем в индукционной катушке при частоте 0.88 MГц, индукции 9.3 кA/м и мощности 0,15 кВт. Комбинированное действие индукционной гипертермии и магнито- термосенсибилизации проверили статистически и тестировали на значимость. Были определены значимые различия между цитотоксическими эффектами, вызванными индукционной гипертермией, магнито- термосенсибилизацией и комбинацией индукционной гипертермии с магнитосенсибилизацией. Действие ФГ в нетоксичных дозах зависит от величины применяемой дозы при +37оС, его повреждающее действие на опухолевые клетки значительно повышается магнито- и тепловым воздействием при +41оС и выше. Магнито- и тепловое повышение повреждающего действия фотогема на клетки эффективно подавляется прибавлением гистидина, который является перехватчиком синглетного кислорода и супероксид радикалa. В присутствии нетоксичных доз ФГ+Гистидин фракция выживших клеток была пропорциональна температуре. Были определены значительные различия между цитотоксическими эффектами, вызванными фотогемом при +37оС и +41оС при тех же концентрациях фотогема. Поэтому цитотоксичность, наблюдающаяся при индукционной гипертермии должна быть отнесена к тепловым эффектам. комбинация Фотогема с Декстранферритом обладает потенциалом магнито- и термосенсибилизатора благодаря следующим преимуществам: отсутствует токсичность при физиологических параметрах электромагнитного поля, понижается доза вводимого препарата; при нетоксичных дозах ФГ+ДФ для повреждения опухолевых клеток кроме ФГ+ДФ требуется магнито-термосенсибилизация (МТС). Комбинация индукционной гипертермии с магнитосенсибилизацией является комбинированным методом, МТС. Эти данные подтверждают возможность использования индукционной гипертермии в комбинации с магнитосенсибилизацией опухолевых клеток фотогемом. При сравнении со светом, преимуществами этого метода являются: неограниченная глубина проникновения магнитного поля в ткани тела при отсутствии токсичности. Дальнейшие исследования in vitro и in vivo позволят подобрать оптимальные дозы ФГ+ДФ и параметры интенсивности и продолжительности действия электромагнитного поля. Экспозиция опухолей в ПМП при +44 оС и выше повышает их чувствительность к химио- и радиотерапии продлевает жизнь экспериментальных животных.
Для проведения МТС in vivo нами разработан индуктор высокочастотных колебаний (ИВЧ), который предназначен для индукционной гипертермии опухолей, рабочая частота, 0,88 МГц, выходная колебательная мощность, 150 Вт.
В представленном индукторе мы провели ФГ-М-ДФ-ТС клеток (Рис. 1-6) и опухолей (Рис. 7). В предварительных опытах, на 9 нормальных мышах самцах C57Bl/6j, сразу после определения температуры электротермометром в прямой кишке и на поверхности кожи, животных помещали в полиэтиленовые оболочки (диаметр 30 мм, длина 180 мм, толщина стенок 3 мм). Каждую мышь в оболочке, помещали в область пересечения продольной и поперечной осей (ОПО) катушки-индуктора, снабженной «щитом Фарадея» (ЩФ). Через катушку продували воздух со скоростью от 0,3 до 1,7 м/сек, включали генератор ПМП и выдерживали 6-60 мин. Сразу после выключения ПМП повторяли измерение температуры в прямой кишке и на поверхности кожи мышей. При экспозиции мышей в ПМП до 9 мин, заметных изменений температуры их тела не наблюдалось. При экспозиции мышей в ПМП более 9 мин нагревалась защитная оболочка и кожа. Кроме того, щит Фарадея (диаметр 58 мм, длина 300 мм), изготовленный из алюминиевой фольги (толщина фольги 0,3 мм), установленный внутри катушки-индуктора уменьшал число искровых разрядов (ИЭР) в 3 раза, полностью не защищал мышей и приводил к перегрузкам и перегреву генератора ПМП. Для преодоления этих трудностей при определениях в ПМП противоопухолевой активности синтезированных препаратов мы заменили ЩФ водяным холодильником (ВХ), который установили коаксильно внутри катушки-индуктора. ВХ выполнен в виде полого стеклянного цилиндра с двойными стенками длиной 470 мм, внешним диаметром 57 мм, внутренним диаметром 36 мм, зазор, между стенками, 18-21 мм заполняется водой, или золями. На каждом конце цилиндра имеется по одной водоотводной трубке длиной 20 мм для присоединения к водопроводу или насосу. В опытах in vitro катушка-индуктор с ВХ устанавливается вертикально, в опытах in vivo – горизонтально так, чтобы области пересечения продольных и поперечных осей (ОПО) ВХ и катушки-индуктора совпадали. Испытуемые образцы от 0,1 до 4,0 мл в термостатированной пробирке, снабженной термометром, устанавливали в ВХО в ОПО регистрировали исходную температуру, включали индуктор ПМП на 3-9 мин и определяли конечную температуру. Внутриопухолевую ФГ-М-ДФ-ТС проводили в двух группах по 9 мышей DBA2 весом от 18 до 20 г (в контрольной группе 6 мышей) при 37°С, и при +41-42 °С (f 0,88 МГц, H 7,2 кА/м, 0,15 кВт, 1х30 мин) с последующим повторением процедуры через 48 час. В экспериментах по изучению эффективности вводили ДФ в дозах 1,5 г/кг, ФГ – от 0,1 до 0,3 мг/кг. ФГ-М-ДФ-ТС проводили в индукторе при параметрах: ПМП 0,88 МГц, 7,2 кА/м, мощностью 0,15 кВт, время воздействия 30 минут. В первой и второй группах суспензию 106 клеток Р388 вводили подкожно в наружную часть бедра. Через 6 суток каждую группу разделили на 3 подгруппы: А, Б, В, по 3 мыши в каждой подгруппе. Мышей иммобилизовали, в опухоль каждой мыши 1 группы вводили 0,09-0,1 мл 30% ФЖ, содержащей от 6 мкг до 1 мкг ФГ. Мышам подгруппы 1А вводили ФЖ, содержащую 6 мкг фотогема, в 1Б – 3 мкг и в 1В – 1 мкг ФГ, мышей выдерживали 5 мин в неоднородном постоянном магнитном поле индукцией 0,2 Тл, надевали полиэтиленовые оболочки. Каждую мышь в оболочке помещали в область ОПО ВХ, включали генератор ПМП. Температуру опухоли поддерживали 30 мин на уровне 41-42°С, при этом температура в прямой кишке не превышала 37°С.
Во 2 группе в опухоль каждой мыши подгруппы 2А вводили золь, содержащий 6 мкг ФГ, в подгруппе 2Б – 3 мкг и в подгруппе 2В – 1 мкг ФГ, надевали полиэтиленовые оболочки. Каждую мышь в оболочке помещали в область ОПО ВХ, включали генератор ПМП. Сразу после выключения ПМП измеряли температуру на поверхности опухоли и в прямой кишке мыши. Температура опухоли и прямой кишки не превышала 37°С. Показано, что ФГ-М-ДФ-ТС угнетала рост опухоли Р388 (рисунок 7), при этом отмечался дозозависимый характер эффекта.
Мыши DBA2 с опухолью Р388. Индуктор ПМП, параметры: f 0,88 МГц, H 7,2 кА/м, мощностью 0,15 кВт, время воздействия 30 минут. При определении ТРО феррижидкость, содержащую магнитосенсибилизатор, вводили внутрь опухоли в дозах: ДФ, 1,5 мг/кг и ФГ, от 0,3 мг/кг (1) до 0,05 мг/кг (2). Пунктирная линия - биологически значимый уровень, * - объем опухолей в опытной группе достоверно отличается от объема опухолей в контроле при р<0,05. 1) При использовании ДФ-ФГ в дозе 1,5 мг/кг-0,3 мг/кг значения ТРО с 6-го по 13-ый день после ФГ-М-ДФ-ТС составили от 33% до 72% соответственно, в дозе 1,5 мг/кг и 0,05 мг/кг – от 20% до 40%. Биологически значимые величины ТРО Р388 наблюдались лишь при применении ФГ в дозе 0,3 мг/кг на 6-8 сутки после проведения ФГ-М-ДФ-ТС. Переменное магнитное поле без предварительного введения ДФ-ФГ и при введении ДФ-ФГ без последующей обработки в ПМП достоверно не влияли на рост опухоли Р388. ВХ, находящийся внутри катушки-индуктора, одновременно выполнял функции ЩФ, защищающего подопытных животных от токсического действия ИЭР и водяного холодильника, изнутри охлаждающего катушку. Поскольку в воде могут распространяться лишь продольные электромагнитные поля, слой воды толщиной 10 – 20 мм фильтрует, проходящее через него ПМП f 0,88 МГц, H 7,2 кА/м, мощностью 0,15 кВт, задерживая поперечное поле. После трехкратного, с интервалом 3 суток, внутриопухолевого введения 0,09-0,1 мл 30% (вес) ДФФЖ, содержащего 6 мкг ФГ в неоднородном постоянном магнитном поле 0,2 Тл с последующей внутриопухолевой индукционной гипертермией при +41-42°С (f 0,88 МГц, H 7,2 1 кВт, 1х30 мин) опухоли мумифицировались и отторгались в течение следующих 3 недель наблюдения.
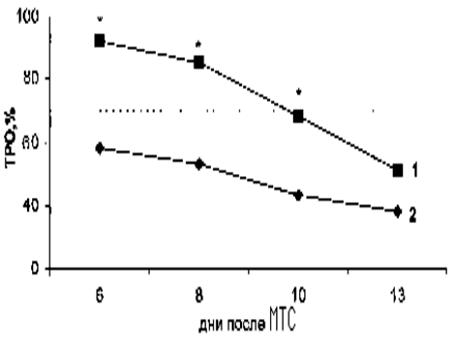
Рисунок 7. Зависимость торможения роста опухолей (ТРО) под
влиянием фотогем-магнито-декстран-феррит-термосенсибилизации.
После трехкратного, с интервалом 3 суток, внутриопухолевого введения 0,09-0,1 мл золя 6 мкг ФГ в неоднородном постоянном магнитном поле 0,2 Тл с последующей внутриопухолевой индукционной гипертермией при +41-42°С (f 0,88 МГц, H 7,2 1 кВт, 1х45 мин) опухоли мумифицировались и отторгались в течение следующих 3 недель наблюдения. В контроле после подкожного введения 10 6 клеток Р388 у всех животных развивались опухоли, от которых они гибли в течение 1 месяца. Средняя продолжительность жизни мышей в контрольной группе составляла 24 дня.
Таким образом, установлены: толерантность млекопитающихся к действию магнитной составляющей переменного магнитного поля; разработан способ защиты животных от токсического действия электрической составляющей, на основе которого создан индуктор высокочастотных колебаний для гипертермии, магнитосенсибилизации и магнито-термосенсибилизации опухолевых клеток и опухолей, содержащих декстранферрит и порфирины. Растворение декстранферрита в воде приводит к образованию феррижидкостей, применимых при индукционной гипертермии и магнито-термосенсибилизации опухолей фотогемом. Механизм защиты от токсического действия электрической составляющей связан с поглощением и рассеиванием энергии электрического поля водой. Механизм ферримагнитного нагрева опухолей, наиболее вероятно, включает процессы потерь при магнитной релаксации. Магнито-термосенсибилизация опухолей порфиринами, наиболее вероятно, включает свободно-радикальные процессы.
Список литературы:
1. Брусенцов Н.А., Шумаков Л. И., Брусенцова Т. Н. // Труды 9 Международной Плесской
конференции по магнитным жидкостям, (2000) Плес, Россия, 2, 297 – 302.
2. Autenshlyus A. I., Brusentsov N. A., Lockshin A. // J. Magn. Magn. Mater. 122 (1993)360-363.
3. Brusentsov N. A., Komissarova L. Kh., Mironov A. F., Lubeshkin A. V., Nikolaeva T. G.,
Bayburtskiy F. S., Filinova E. Yu., Shumakov L. I., Brusentsova T. N., Baryshnikov A. Yu. //
Fourth Int. Conf. on the Scientific and Clinical Applications of Mgnetic Carriers, (2002)
Tallahassee, Florida, U.S.A. 81-84.
4. Brusentsov N. A., Gogosov V. V., Brusentsova T. N., Sergeev A.V., Jurchenko N.Y.,
Shumakov L. I. // J. Magn. Magn. Mater. 225 (2001)113-117.
5. Babincova M., Leszczynska D., Sourivong P., Babinec P. // J. Magn. Magn. Mater. 225 (2001)
194-196.
6. Saito A., Tanaka R., Takahashi H., Kakimura K. // J. Hyperthermia 14 (1998) 503-511.
7. Brusentsov N. A., Jurchenko N. Y., Osipov N. E., Bayburtskiy F. S. //
J. Magn. Magn. Mater. 194 (1999) 83-89.
8. Häfeli U. O., Pauer G. J. // J. Magn. Magn. Mater. 194 (1999) 76-82.
9. Ларионов Л. Ф. Химиотерапия злокачественных опухолей, Мед. лит. М. 1962.