ДЕТОКСИКАЦИЯ
ОРГАНИЗМА С ИСПОЛЬЗОВАНИЕМ МАГНИТОУПРАВЛЯЕМЫХ СОРБЕНТОВ
Комиссарова Л. Х. 1, Филиппов В. И. 1,
Гончаров Л. А. 1, Попова Т. С. 2,
Кутушов М. В. 2, Мартынов А. Н. 3,
Брусенцов Н. А. 1, Байбуртский Ф. С. 1
1. Институт
биохимической физики имени Н. М. Эмануэля РАН,
г.
Москва, ул. Косыгина, д. 4, Chembio@.sky.chph.ras.ru, Bayburt@mail.ru
2. Научно-исследовательский
институт скорой помощи имени М.В. Склифосовского,
г.
Москва, Большая Сухаревская площадь, д. 3.
3.
Научно-исследовательский институт физико-химической медицины РАМН.
г.
Москва, ул. Малая Пироговская, д. 117.
Для детоксикации организма
от эндо- и экзотоксинов наибольшее распространение в клинической практике
имеют такие методы, как гемодиализ, ультрафильтрация и гемосорбция. Гемодиализ
и ультрафильтрация в основном используются для удаления низкомолекулярных
соединений. Соединения со средним молекулярным весом и тем более с высоким не
проходят через мембрану диализатора. Методы требуют большого объема
одномоментно выводимой из организма крови, вызывают травматизацию форменных
элементов крови и, кроме того, являются дорогостоящими. Метод гемосорбции с
использованием стандартных колонок, заполненных гемосорбентами, позволяет
расширить диапазон выводимых из крови токсинов [1], однако, имеет ряд
негативных сторон: большой объем выводимой из организма крови, низкую
эффективность сорбции токсинов, травматизацию крови и изменение ее биохимических
показателей. Отрицательное воздействие на кровь обусловлено как длительным
контактом крови (более 1 час) с активированным углем, наиболее широко
используемым в качестве гемосорбента, так и с высоким гидравлическим
сопротивлением из-за необходимости применения определенного типа насосов для
прокачки большого объема крови через колонку. Уменьшение размера частиц
адсорбента для повышения эффективности сорбции приводит к увеличению
гидравлического сопротивления и возрастанию повреждающего воздействия на
кровь.
Нами предложен и испытан
новый метод и устройство для детоксикации биологических сред организма с
использованием в качестве адсорбентов ферромагнитных частиц микронного и
субмикронного размеров различного состава [2]. Обычно использовалось композитные
частицы, магнитной фазой которых являлось железо или его окислы, сорбирующей фазой
– углерод, окислы кремния или алюминия, испытывалось также восстановленное
железо. Эти частицы благодаря малым размерам имеют высокую сорбционную емкость
и скорость удаления целевых компонентов из биологических жидкостей.
1. Общая схема магнитной гемосорбции:
Кровь, выведенная из артерии, смешивается с суспензией ферромагнитных частиц (рисунок 1), новые порции которой постоянно поступают в камеру смешивания. После завершения процесса сорбции частицы адсорбента, содержащие токсины, отделяются в магнитном сепараторе, а очищенная кровь возвращается в организм. Использование насоса не является обязательным, кровь может двигаться за счет артериовенозного перепада давления, что значительно снижает травматизацию клеток крови; объем крови, требуемый для заполнения устройства и систем коммутации (40-80 мл), значительно меньше, чем в стандартном методе гемосорбции (150-350 мл). Процесс адсорбции происходит в ламинарном потоке смеси крови и магнитных частиц. Время взаимодействия частиц с кровью определяется длиной и сечением трубки коммутации от камеры смешивания суспензии с кровью до магнитного сепаратора и скоростью потока крови и составляет порядка 2 – 10 секунд.
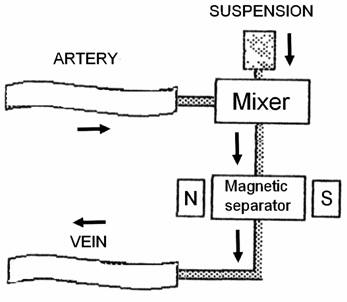
Рисунок
1. Обшая схема магнитной гемосорбции
2. Материалы и методы:
Большая часть исследований была выполнена с использованием железо-углеродных частиц, полученных термокаталитическим способом (реакция между оксидом углерода и окислами железа) или плазмохимическим методом [3]. Для опытов в стационарных условиях использовались также частицы восстановленного железа с содержанием окислов менее 10% и композиты состава железо-углерод и железо-окислы кремния, полученные термическим методом [4]. Магнитная восприимчивость магнитоуправляемых сорбентов (МУСов) определялась с помощью магнетометра Фарадея [3].
Был проведен скрининг сорбционной эффективности МУСов (около 100 образцов) к низко-, средне- и высокомолекулярным соединениям. В качестве низкомолекулярных соединений были взяты барбитураты (натрия тиопентал, натрия гексенал, натрия фенобарбитал), средних молекул – цианкобаламин (витамин В12 и билирубин, макромолекул – человечий гемоглобин.
Известно [1], что углерод, железо
или его окислы при контакте с кровью вызывают повреждение эритроцитов и
тромбоцитов, нарушение баланса компонентов плазмы, в том числе, альбумина и
глобулинов, обусловленного их сорбцией. В связи с этим проводилась химическая
модификация поверхности МУСов белками или полисахаридами. В опытах in vivo (на собаках) модификацию осуществляли ex temporary путем смешивания порошка феррочастиц в растворе
желатиноля с помощью ультразвука для диспергирования конгломератов. В серии
опытов в стационарных условиях поверхность МУСов покрывали альбумином,
желатином или декстраном по методу Wieder [1979] в нашей модификации
[4]. Белки или полисахариды, сорбированные на ферромагнетиках, фиксировались в
их структуре реакцией с глутаровым альдегидом. МУСы с модифицированной
поверхностью не теряли сорбционной активности при хранении их водных растворов
при температуре 4-6оС. МУСы на основе окислов кремния не оказывают
повреждающего воздействия на кровь и не требуют модификации.
Сорбционная эффективность
МУСов определялась как отношение адсорбированного вещества к первоначальному
его количеству (по весу) и выражалась в процентах. Исследования в статических
условиях проводились при концентрациях веществ 100-200 мкг/мл и весовых
отношениях адсорбент вещество равными: 1; 2,5; 5; 10; 25; 50. Вещества в 10 мл
физиологического раствора, или донорской плазмы, или донорской крови
перемешивались с МУСом при комнатной температуре 1 мин. После осаждения частиц
МУСа с помощью самарий-кобальтового магнита напряженностью порядка 0,5 Тл
определяли концентрацию веществ в надосадочной жидкости с помощью
дифференциальной спектрофотометрии в ультрафиолетовой и видимой областях. В
плазме и донорской крови концентрацию соединений определяли с помощью
тонкослойной хромотографии с применением флуоресцентного индикатора и
дифференциальной спектрофотометрии безбелковых фильтратов.
Исследования в динамических
условиях проводили на экспериментальной установке, состоящей из магнитного
сепаратора, емкости, содержащей суспензию МУС, устройства смешивания суспензии
МУС с физиологическим раствором или свежецитратной кровью с заданной
концентрацией токсинов, системы коммутаций, емкостей для подачи и сбора биологических
жидкостей.
Магнитный сепаратор
представляет собой прямоугольную камеру, выполненную из тефлона, объемом 10 см3,
внутри которой расположена ферромагнитная проволока диаметром 0,5-1 мм. Снаружи
камеры с двух сторон фиксируются по два постоянных магнита, выполненных из
сплава неодим-железо-бор с размерами 40х40х10 мм. и снабжаются магнитопроводом.
Магнитная индукция в сепараторе достигала 1 Тл. В устройство для смешивания объемом
5 см3, выполненного из полистирола, одновременно поступает суспензия
МУСа с помощью перистальтического насоса и очищаемая биологическая жидкость с
помощью роликового насоса; в экспериментах на животных ток крови осуществлялся
за счет артериовенозного перепада давления Смеситель соединялся с магнитным
сепаратором коммутационными трубками из пластика. В модельных экспериментах
поток очищаемой жидкости объемом 1000 мл подавался со скоростью 100 мл/мин при
температуре 25°С. Растворы барбитуратов, цианкобаламина и гемоглобина с
концентрацией 100 мкг/ мл пропускались через устройство 1, 2 или 3 раза при
непрерывном перемешивании с суспензией МУСа с концентрацией, поддерживаемой на
уровне 0,5 мкг/мл. Для оценки качества работоспособности магнитного сепаратора
проводились измерения намагниченности образцов выходящей из сепаратора биологической
жидкости.
Для сравнения были проведены опыты по сорбции барбитуратов на образцах активированного угля марки СКТ-6А в статических и динамических условиях.
Исследования эффективности
предложенного устройства in vivo проводили на собаках весом
от 12 до 19 кг. Затравку осуществляли путем внутривенного введения
фенобарбитала натрия в дозе 400-600 мг/кг массы тела; при этом концентрация
барбитуратов в крови достигала 100-200 мкг/мл. Животным накладывали
артериовенозный шунт на бедре, к которому подключали магнитное сепарирующее
устройство. Брали пробы крови до начала опыта и в процессе гемосорбции в
течение 60 мин для определения биохимических, реологических и иммунологических
показателей, также определяли концентрацию барбитуратов.
3. Результаты и обсуждение:
В опытах в статических условиях обнаружено, что эффективность адсорбции барбитуратов для МУСов типа железо-углерод возрастает с увеличением доли углерода от 20 до 80 % (рисунок 2), но при этом снижаются значения магнитной восприимчивости образцов, что усложняет магнитную сепарацию частиц. Оптимальными по сорбционным и магнитным характеристикам являются образцы МУСов с содержанием углерода 40-50 % и магнитной восприимчивостью не менее 50 еmu/g. Эффективность адсорбции соединений различной молекулярной массы зависит от типа адсорбента, состава и структуры молекул адсорбата и адсорбента, отношения массы адсорбента к массе адсорбата (рисунок 3). Кривые эффективности адсорбции гексенала натрия и тиопентала натрия были аналогичными. Оптимальное отношение адсорбента к адсорбату для МУСов типа железо-углерод в статических условиях для барбитуратов составляет: 15-20, для цианкобаламина и билирубина: 20-25, для гемоглобина: 40-50. Эффективность адсорбции для данного типа адсорбента и адсорбата зависит также от химической модификации его поверхности.
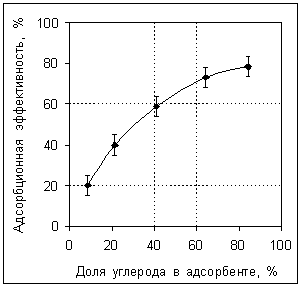
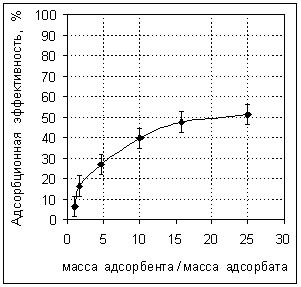
Рисунок 2. Эффективность адсорбции Рисунок 3. Эффективность
адсорбции
барбитурата (гексенал натрия)
от фенобарбитала
натрия МУСом типа
содержания углерода в МУСе. железо-углерод от отношения
масс
адсорбент / адсорбат.
Таблица 1.
Сорбционная эффективность МУСов к
веществам
различной молекулярной массы в физиологическом
растворе при рН 7,4
|
Тип МУСа |
Сорбционная
эффективность, % ( ± Δ % ) |
|||||
|
Восстановленное Железо |
Фенобарбитал Молекулярная масса 232 |
Цианкобаламин Молекулярная
масса 1355 |
Гемоглобин Молекулярная
масса 64000 |
|||
|
Немодиф. МУС |
Модиф. желатином |
Немодиф. МУС |
Модиф. желатином |
Немодиф. МУС |
Модиф. желатином |
|
|
38,6 ± 6,3 |
40,4 ± 7,4 |
9,0 ± 6,1 |
11,1 ± 3,4 |
32,3 ± 7,1 |
54,4 ± 8,2 |
|
|
Железо – углерод |
49,9 ± 6,8 |
55,2 ± 7,0 |
21,4 ± 5,3 |
23,2
± 6,1 |
37,6
± 7,6 |
52,7
± 7,8 |
|
Железо – кремний |
85,7
± 10,2 |
|
33,5
± 7,7 |
|
22,5
± 5,8 |
|
Как видно из таблиц 1 и 2,
сорбционная эффективность железо и железо-углеродных МУСов с модифицированной
и немодифицированной поверхностью к барбитуратам (на примере фенобарбитала
натрия) и цианкобаламина в физиологическом растворе и донорской плазме была
практически одинаковой. Это свидетельствует о том, что большая часть пор,
характерная для данного типа адсорбента, остается доступной для молекул этих
веществ. В то же время, сорбционная эффективность модифицированных МУСов по
отношению к гемоглобину (табл. 1 и 2) и билирубину (табл. 3) возрастает. Механизм
сорбции гемоглобина и билирубина [5] на
модифицированных белками МУСах, очевидно, обусловлен электростатическим
взаимодействием карбоксильных групп желатина и альбумина с аминогруппами гемоглобина
или метильными группами билирубина.
Таблица 2.
Сорбционная эффективность
МУСов к веществам
различной молекулярной массы
в донорской плазме.
|
Среда Инкубации (рН 7,4) |
Сорбционная эффективность,
% ( ± Δ %) |
||
|
Без модифицирования |
Модифицирование желатином |
Модифицирование альбумином |
|
|
Физиологический раствор |
29,0
± 5,7 |
66,7 ± 7,4 |
70,8 ± 8,6 |
|
Донорская плазма |
0 |
34,4
± 5,9 |
59,2 ± 8,1 |
Таблица 3.
Сорбционная
эффективность МУСов (типа железо-углерод) к билирубину.
|
Вещества |
Сорбционная эффективность,
% ( ± Δ %) |
||
|
Железо – кремний |
Железо – углерод, модиф. желатином |
Железо – углерод, модиф. альбумином |
|
|
Фенобарбитал |
67,3 ± 8,4 |
46,8 ± 7,9 |
43,1 ± 7,2 |
|
Цианокобаламин |
23,1 ± 4,3 |
13,5 ± 4,1 |
15,7 ± 5,8 |
|
Билирубин |
£ 42 |
34,3 ± 5,9 |
59,2 ± 10,3 |
|
Гемоглобин |
11,9 ± 3,8 |
39,4 ± 7,0 |
44,5 ± 6,6 |
Высокие значения сорбционной
эффективности барбитуратов обнаружены для железо-силикатных МУСов (таблицы 1 –
2). Гемосовместимые железо-силикатные и железо-алюмосиликтные МУСы могут быть
использованы также для селективного извлечения креатинина и других метаболитов.
Эксперименты в динамических условиях с использованием магнитного сепарирующего
устройства проводились с МУСами типа железо-углерод («Цефесорб»). При
проведении 2-х или 3-х циклов гемосорбции концентрация метаболитов
(барбитураты, цианкобаламин, гемоглобин) снижалась до уровня 5-15 %, что
превосходит эффективность гемосорбции на активированном угле (при одинаковых массах адсорбента) в 2-2,5
раза. Анализ растворов и донорской крови, прошедших через сепаратор, показал
отсутствие в них частиц МУСов, что свидетельствует о практически их полном
удерживании в сепараторе.
Метод магнитной экстракорпоральной детоксикации был апробирован на
собаках. Рисунок 4 демонстрирует эффективность удаления из крови собак
фенобарбитала натрия с использованием МУСа «Цефесорб» и перфузии через
колонку с активированным углем марки СКТ-6А. При использовании 10 г МУСа и
такого же количества СКТ-6А концентрация фенобарбитала натрия в крови за 60
мин. гемосорбции снизилась до 25 % и 60 % соответственно. Результаты анализа
некоторых биохимических показателей крови собак до и после магнитной
гемосорбции представлены в таблице 4. Из таблицы видно, что отмечалось небольшое
снижение концентрации белков. Изменений других биохимических показателей и
гемолиза эритроцитов не обнаружено.
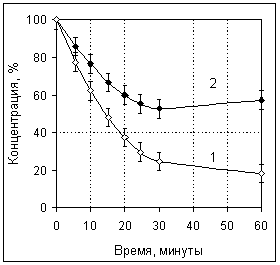
Рисунок
4. Эффективность удаления фенобарбитала натрия из крови собак
при
использовании МУСа «Цефесорб» (1) и активированного угля марки СКТ-6А (2).
Таблица
4. Биохимические показатели крови собак до и после магнитной гемосорбции
|
Показатели |
До гемосорбции |
После гемосорбции |
|
Общий белок, мг / мл |
78,8 |
63,0 |
|
Альбумин, мг / мл |
25,3 |
20,0 |
|
Глобулины, мг / мл |
52,2 |
43,2 |
|
Мочевина, мкг / мл |
4,6 |
4,4 |
|
Креатинин, мкг / мл |
96,6 |
26,0 |
|
Билирубин, мкг / мл |
3,6 |
3,7 |
|
Калий, мкг / мл |
3,3 |
2,6 |
|
Гемолиз, % |
0,100 |
0,062 |
4. Заключение:
Предложен и испытан новый метод и устройство для экстракорпоральной детоксикации организма с использованием магнитоуправляемых сорбентов (МУСов). Показано, что эффективность удаления барбитуратов из крови животных (собаки) при магнитной гемосорбции значительно превосходит таковую при использовании стандартной сорбционной колонки с активированным углем. Малые габариты устройства, небольшой объем одномоментно выводимой из организма крови позволяет применять метод магнитной гемосорбции не только в стационарных условиях, но и на догоспитальном этапе при эндо- и экзотоксикозах различной этиологии, в том числе, при химиотерапии для понижения токсических эффектов противоопухолевых препаратов. Возможность химической модификации поверхности МУСов позволяет синтезировать на их основе магнитные иммуносорбенты с целью удаления из биологических сред патогенной микрофлоры и вирусов.
Список
литературы:
1. Лопухин Ю.М., Молоденков М.Н. Гемосорбция. М.,
Медгиз. 1985.
2. Комиссарова Л.Х., Филиппов В.И. и др. Патент РФ №
2008929, 1991.
3. Филиппов В.И., Кутушов М.В. //
Scientific and Clinical Applications of Magnetic Carriers
Plenum-Press, New-York, 1997,
p. 380.
4. Комиссарова Л.Х., Кутушов М.В, Глухоедов Н.П. //
Патент РФ № 2109522, 1996.
5. Комиссарова Л.Х., Кутушов М.В. // J. Magn. Magn. Mater. 225 (2001) 197.